Questões Sobre Distribuição Eletrônica - Química - 1º ano do ensino médio
11) Quando os fabricantes desejam produzir fogos de artifício coloridos, eles misturam à pólvora compostos de certos elementos químicos apropriados. Por exemplo, para obter a cor vermelho-carmim, colocam o carbonato de estrôncio (SrCO3); para o azul-esverdeado, usam o cloreto de cobre (CuCl2 ) e, para o verde, empregam o cloreto de bário (BaCl2) .
- A) apenas I.
- B) apenas II.
- C) apenas III.
- D) apenas I e II.
- E) apenas II e III.
FAZER COMENTÁRIOA alternativa correta é letra D
Analisando-se cada uma das afirmativas:I - O íon Sr2+ possui 38 prótons e 36 elétrons. VERDADEIRO.O elemento químico Estrôncio (Sr) possui número atômico igual a 38. Isto significa que o átomo neutro possui um total de 38 prótons e 38 elétrons. Ao ser formado o íon Sr2+, dois elétrons são retirados do átomo neutro, portanto, mantém-se o número de prótons (38) e o número de elétrons é diminuído em duas unidades, restando 36 elétrons no Sr2+II -O íon Ba2+ é isoeletrônico com o átomo de xenônio. VERDADEIRO.O Bário (Ba) possui em seu estado neutro um total de 56 elétrons, correspondentes aos seus 56 prótons. O íon Ba2+, por sua vez, possui dois elétrons a menos que o estado neutro, ou seja, apresenta um total de 54 elétrons. O Xenônio, cujo número atômico é 54, também apresenta 54 elétrons. Portanto, pode-se dizer que o íon Ba2+ é isoeletrônico (tem a mesma quantidade de elétrons) com o átomo de xenônio.III -Se o átomo de cobre perde um elétron, ele se torna um ânion com 28 elétrons. FALSO.O átomo neutro de Cobre (Cu) possui número atômico igual a 29. Isto significa que possui um total de 29 prótons e, consequentemente, 29 elétrons. Ao se perder um elétron (carga negativa) forma-se um cátion, ou íon positivo, com 28 elétrons.Assim, a alternativa correta é D.12) Para que átomos de enxofre e potássio adquiram configuração eletrônica igual à dos gases nobres, é necessário que: Dados: Números atômicos: S = 16; K = 19.
- A) o enxofre receba 2 elétrons e que o potássio receba 7 elétrons
- B) o enxofre ceda 6 elétrons e que o potássio receba 7 elétrons
- C) o enxofre ceda 2 elétrons e que o potássio ceda 1 elétron
- D) o enxofre receba 6 elétrons e que o potássio ceda 1 elétron
FAZER COMENTÁRIO- E) o enxofre receba 2 elétrons e que o potássio ceda 1 elétron
A alternativa correta é letra E
Os gases nobres possuem configuração eletrônica única. Eles possuem, em sua camada mais externa, oito elétrons. Pelo número atômico, podemos determinar a configuração eletrônica dos dois átomos:S (16 elétrons): 1s22s22p63s23p4K (19 elétrons): 1s22s22p63s23p64s1Dessa forma, o enxofre possui 6 elétrons na última camada (camada 3) e ele precisaria receber 2 elétrons para adquirir configuração de gás nobre.O potássio possui apenas um elétron na última camada e ele está na família 1. Dessa forma, é mais fácil ele perder um elétron do que ganhar 7 elétrons para ficar com a configuração de um gás nobre.Portanto a alternativa "e" é a correta.13) Na Classificação Periódica, a coluna 1 refere-se aos elementos alcalinos e a coluna 17 refere-se aos halogênios. Metais alcalinos como Lítio, Sódio e Césio reagem com gases halogênios como Cl2. Os produtos das reações dos metais Lítio, Sódio e Césio com o gás Cl2 são sólidos iônicos cujas fórmulas são, respectivamente,
- A) LiCl2, NaCl, CsCl.
- B) LiCl, NaCl2, CsCl.
- C) LiCl2, NaCl2, CsCl2.
- D) LiCl3, NaCl3, CsCl3.
FAZER COMENTÁRIO- E) LiCl, NaCl, CsCl.
A alternativa correta é letra E
Conforme as informações fornecidas no enunciado, os elementos Lítio (Li), Sódio (Na) e Césio (Cs) pertencem ao grupo 1, assim, possuem um elétron de valência, que é doado na ligação iônica com o Cloro (Cl). Este, por sua vez, por pertencer ao grupo 17, possui 7 elétrons de valência, e para que fique mais estável, conforme a Regra do Octeto, em uma ligação iônica, ele recebe um elétron. Dessa forma, os compostos formados pelos metais alcalinos citados com o cloro são: LiCl , NaCl e CsCl, o que torna a alternativa E como correta.14) O subnível mais energético do átomo de um elemento é 4p3. Portanto, o seu número atômico e a sua posição na Tabela Periódica serão:
FAZER COMENTÁRIO- A) 33, 5A, 5o período
- B) 33, 5A, 4o período
- C) 33, 4A, 5o período
- D) 28, 4A, 4o período
- E) 23, 4A, 4o período
A alternativa correta é letra B
Para determinarmos o número atômico deste elemento, devemos utilizar o diagrama de Pauling até o subnível indicado no enunciado:1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p3Conforme a convenção adotada por Pauling, ao se utilizar tal sequência os expoentes indicados para cada subnível indica a quantidade de elétrons localizados nesses orbitais. Assim, somando-se todos os expoentes, é possível obter o número total de elétrons presentes no átomo representado. Como num átomo neutro o número de prótons é igual ao número de elétrons, a partir da configuração eletrônica podemos saber qual o número atômico deste elemento:nº de elétrons: 2+2+6+2+6+2+10+3 = 33n° atômico: 33A partir desta configuração, também podemos identificar sua posição desse elemento na tabela periódica.A camada mais externa desse átomo é identificada a partir do subnível de maior coeficiente indicado na configuração eletrônica. Para o elemento em questão, podemos concluir que os elétrons de valência estão localizados na camada 4 e, portanto, tal elemento pertence ao 4º período da tabela periódica.Além disso, podemos identificar a família da tabela periódica a que este elemento pertence a partir da quantidade de elétrons que apresenta na camada de valência. Podemos afirmar que esse elemento apresenta um total de 5e- (4s2 4p3 = 5e-) na camada de valência. Com base nessa informação, conclui-se que este elemento faz parte da família 5A.Alternativa correta, B.Questão 15
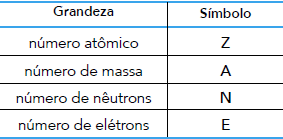 O oxigênio é encontrado na natureza sob a forma de três átomos: 16O, 17O e 18O. No estado fundamental, esses átomos possuem entre si quantidades iguais de duas das grandezas apresentadas.
O oxigênio é encontrado na natureza sob a forma de três átomos: 16O, 17O e 18O. No estado fundamental, esses átomos possuem entre si quantidades iguais de duas das grandezas apresentadas.
Os símbolos dessas duas grandezas são:FAZER COMENTÁRIO- A) Z e A.
- B) E e N.
- C) Z e E.
- D) N e A.
A alternativa correta é letra C
O número atômico Z do oxigênio é igual a 8, indicando que todos os átomos de oxigênio contêm 8 prótons em seu núcleo. No estado fundamental, o número de prótons é igual ao número de elétrons E. Por consequência, todos os átomos de oxigênio contêm 8 elétrons em sua nuvem eletrônica. Na representação de cada átomo de oxigênio, é indicado o número de massa A, que corresponde à soma do número de prótons (número atômico) e do número de nêutros N.
A partir dessa informação, é possível calcular o número de nêutrons de cada átomo: N = A – Z.
As duas grandezas que são idênticas em todos os átomos são Z e E.
16) Os metais alcalino-terrosos, como o estrôncio, pertencentes ao grupo 2 da Tabela Periódica, têm a tendência de perder dois elétrons para a formação de sais com os halogênios pertencentes ao grupo 17, como o iodo. Considerando o isótopo 3888Sr, assinale a alternativa em que todas as informações estão corretas. NÚMERO DE PARTÍCULAS CONSTITUINTES DO CÁTION FÓRMULA DO IODETO DE ESTRÔNCIOREPRESENTAÇÃO DO CÁTION Nêutrons Prótons Elétrons
FAZER COMENTÁRIO- A)SrI3888Sr+883837
- B)SrI3888Sr+503737
- C)SrI23888Sr+883737
- D)SrI23888Sr2+503836
- E)SrI23888Sr2+883836
A alternativa correta é letra D
O isótopo apresenta:Número de massa (A) = 88.Número atômico (Z) = 38.Número de prótons (p) = 38.Número de nêutrons (n):A = n + Z88 = n + 38n = 50.Número de elétrons (e-) = 38.Como pertence ao grupo 2 da Tabela Periódica, o estrôncio tem a tendência de doar dois elétrons, sendo assim as características do cátion são:(38p, 36e-, 50n)Elementos do grupo 17 têm a tendência de receber um elétron, pois é esta a quantidade de elétrons que falta para que completem o octeto.Sendo assim, a fórmula será:17) Segundo pesquisas recentes, há uma bactéria que parece ser capaz de substituir o fósforo por arsênio em seu DNA.
- A) número de elétrons
- B) soma das partículas nucleares
- C) quantidade de níveis eletrônicos
FAZER COMENTÁRIO- D) configuração da camada de valência
A alternativa correta é letra D
De acordo com a tabela periódica, o fósforo e do arsênio pertencem ao grupo 15, o que indica que esses elementos químicos apresentam a mesma configuração eletrônica de última camada, a camada de valência, do tipo ns2 np3. O fósforo tem número atômico 15, e sua distribuição eletrônica é 1s2 2s2 2p6 3s2 3p3. Logo, a camada de valência do fósforo é 3s2 3p3. O arsênio tem número atômico 33, e sua distribuição eletrônica é 1s2 2s2 2p6 3s2 3p3 4s2 3d10 4p3. Logo, a camada de valência do arsênio é 4s2 4p3. Portanto, os átomos desses dois elementos químicos apresentam a mesma configuração da camada de valência. A alternativa correta é a letra D.18) Com relação ao grupo do oxigênio na classificação periódica, se existe H2O, é provável que exista também:
- A) H2S
- B) H3Se
- C) H4S
- D) H4Se
FAZER COMENTÁRIO- E) H4O
A alternativa correta é letra A
Elementos químicos que fazem parte de um mesmo grupo da tabela periódica apresentam o mesmo número de elétrons de valência, diferindo apenas em relação à camada de valência em que estes se encontram. Ou seja, os elementos de um mesmo grupo da tabela periódica compartilham, doam, ou recebem o mesmo número de elétrons, fazendo a mesma quantidade de ligações químicas com outros átomos.Considerando-se a análise anterior e que a fórmula molecular é uma forma de se representar a melhor proporção entre os átomos que compõem uma determinada espécie química, podemos concluir que se existe a substância cuja fórmula molecular é H2O, existe também a de fórmula H2S.Alternativa correta, A.19) De acordo com a imagem e as informações fornecidas no texto é correto concluir, a respeito do elemento zinco, que
FAZER COMENTÁRIO- A) pode apresentar número de oxidação +2.
- B) apresenta número de nêutrons igual a 30.
- C) apresenta 8 elétrons na camada de valência.
- D) a passagem do estado sólido para o líquido ocorrerá 907°C.
- E) a passagem do estado líquido para o gasoso ocorrerá a 419,5°C.
A alternativa correta é letra A
O número atômico representa o número de prótons de um elemento e sua massa o número de prótons somado ao de nêutrons. Se a massa do zinco é 65 e o número atômico é 30, então o número de nêutrons é 35.
A camada de valência é a última camada de distribuição a receber elétrons e pela sua distribuição 1s2 2s2 2p6 3s2 3p6 3d10 4s2 a camada de valência possui 2 elétrons.
O que representa a passagem do estado sólido para o líquido é a temperatura do ponto de fusão e este para o zinco é 419,5 °C. A temperatura de ebulição para este elemento passar do estado líquido pata gasoso é 907° C.
Pela semirreação de oxidação, vê-se que o zinco tem número de oxidação +2, pois tem 2 elétrons na camada de valência.Continua após a publicidade..20) O estrôncio-90, Sr3890, é o principal isótopo desse elemento químico encontrado nos reatores nucleares. Sobre esse isótopo, é correto afirmar que seu cátion bivalente possui
FAZER COMENTÁRIO- A) 38 prótons, 50 nêutrons e 36 elétrons.
- B) 36 prótons, 52 nêutrons e 38 elétrons.
- C) 38 prótons, 50 nêutrons e 38 elétrons.
- D) 38 prótons, 52 nêutrons e 36 elétrons.
- E) 36 prótons, 52 nêutrons e 36 elétrons.
A alternativa correta é letra D
Z = 38
A = 90
Z = número de prótons
p = 38
A = N + Z
90 = N + 38
N = 52 C
Cátion bivalente: Sr2+
O átomo perdeu dois elétrons e -= 36 - B) H3Se
- B) soma das partículas nucleares
- B) LiCl, NaCl2, CsCl.
- B) o enxofre ceda 6 elétrons e que o potássio receba 7 elétrons
- B) apenas II.
