Questões Sobre Funções Inorgânicas - Química - 1º ano do ensino médio
61) A água para consumo humano deve respeitar parâmetros de aspectos físicos, químicos e biológicos determinados. Um exemplo de água quimicamente inconveniente para consumo, e que pode causar danos econômicos, é aquela que possui elevada concentração de sais de cálcio e magnésio dissolvidos. Estes dificultam a utilização da água para lavagem e danificam sistemas de aparelhos que usam água aquecida, como maquinários das indústrias e das residências. A água, nessas condições, é conhecida como água
- A) dura.
- B) ácida.
- C) potável.
- D) patogênica.
A alternativa correta é letra A
Resposta A.
O enunciado descreve a "água dura" caracterizada pela presença de cátions provenientes de sais de cálcio, magnésio e ferro II dissolvidos.
O enunciado descreve a "água dura" caracterizada pela presença de cátions provenientes de sais de cálcio, magnésio e ferro II dissolvidos.
62) Na indústria de sabão duro usa-se um glicerídeo que é hidrolisado por uma base forte. A substância que pode ser usada na fabricação do sabão duro é:
- A) KMnO4;
- B) NaOH;
- C) MnO2;
- D) H2CO3;
FAZER COMENTÁRIO- E) HCl.
A alternativa correta é letra B
O único composto entre as alternativas que é uma base é o hidróxido de sódio, NaOH. Os compostos KMnO4 e o MnO2 são óxidos, enquanto o H2CO3 e o HCl são ácidos.Portanto, alternativa b.63) De uma certa substância, fazemos as afirmações a seguir:
- A) BaSO4
- B) CH4
- C) Mg(O
- D)2
- E) SO3 FAZER COMENTÁRIO
A alternativa correta é letra C
I. Se reage com ácido, dando os produtos de uma reação de neutralização (sal e água), logo, o composto é uma base.II. A dissociação parcial indica que a base em questão é uma base fraca.III. Se, em presença de fenolftaleína, fica vermelho, confirma a idéia de que o composto é básico.Portanto, a única opção é o hidróxido de magnésio, alternativa C.64) O agricultor corrige a acidez do solo usando CaCO3,que reage com íons de H+. Não havendo calcário, o que o agricultor poderá usar com a mesma finalidade?
- A) HCl;
- B) H2O;
- C) Ca(O
- D)2;
- E) H2SO4; FAZER COMENTÁRIO
A alternativa correta é letra C
A questão aborda o conceito de identificação de bases. Para combater a acidez do solo, é necessário a adição de uma base, pois ela neutralizará o excesso de H+ presente no solo. Assim, dentre as alternativas, somente uma base está listada, que é o Ca(OH)2 , hidróxido de cálcio. Assim, a alternativa correta é a C.65) Da reação de neutralização completa do ácido clorídrico e do hidróxido de sódio pode se obter sal e água. Qual das reações químicas abaixo melhor exemplifica este processo:
- A) HCl + H2O → NaCl + NaOH
- B) NaCl + H2O → HCl + NaOH
- C) HCl + SoOH → SoCl + H2O
- D) 3HCl + 2NaOH → 5NaCl +6H2O
FAZER COMENTÁRIO- E) HCl + NaOH → NaCl + H2O
A alternativa correta é letra E
O sódio é um metal da família dos alcalinos terrosos gera o cátion Na+. O hidróxido é o ânion OH-. Portanto a fórmula do hidróxido de sódio é NaOH.O hidrogênio gera o cátion H+, enquanto o ânion cloro (que está na família 17) é representado por Cl-. Assim, a fórmula do ácido clorídrico é HCl.A reação de neutralização desses ácidos é:HCl + NaOH → NaCl + H2OA opção E é a correta.66) Considere as seguintes afirmações:
- A) I, II, III e IV.
- B) I, II e III, apenas.
- C) I, III e IV, apenas.
- D) II, III e IV, apenas.
FAZER COMENTÁRIO- E) II e IV, apenas.
A alternativa correta é letra D
Com base nas informações do texto de referência e em algumas definições da Química, podemos analisar cada uma das afirmações:I. o HCl é um ácido mais forte que o HBr - FALSO. Os ácidos citados apresentam os seguinte valores de pka, segundo o texto:HCl: pKa = -8HBr: pKa = -9Pela definição de pka, podemos concluir qual dos ácidos citados será mais forte:pKa = -log KaPara o HCl: -8 = - log Ka ∴ Ka = 108Para o HBr: -9 = -log Ka ∴ Ka = 109Sendo Ka (constante de dissociação ácida) definida pela seguinte relação, para um ácido genérico HA:Desta relação, podemos concluir que quanto maior o valor de Ka, maior a força do ácido, pois maior será a concentração dos íons H+(aq) na solução. Portanto, dentre os ácidos citados, o HBr é o ácido mais forte, pois apresenta o maior valor de Ka.II. a ligação H-Cl é mais forte que a ligação H-Br - VERDADEIRO. Como o HCl é ácido mais fraco que o HBr (alternativa anterior), podemos concluir que apresenta a ligação mais forte. A ligação mais forte do H-Cl resulta na sua menor dissolução em solução aquosa, pois será necessária uma maior quantidade de energia para romper essa ligação e gerar os íons H+(aq) e Cl-(aq), quando comparado ao HBr.III. a dissolução do HBr na água é um processo exotérmico - VERDADEIRO. Pode-se constatar experimentalmente que uma reação exotérmica é beneficiada pela diminuição da temperatura, ao passo que, o aumento da temperatura desfavorece esse tipo de reação. Como os dados fornecidos pela questão (tabela) informam que, à medida que a temperatura da água aumenta, a dissolução do HBr diminui, podemos inferir que trata-se de uma dissolução exotérmica.IV. durante a dissolução do HBr em água, verifica-se que há um aumento da temperatura da água. VERDADEIRO. Conforme concluído na alternativa anterior, a dissolução do HBr em água, trata-se de um processo exotérmico. Assim, ao longo do processo haverá liberação de energia, ocasionando o aumento da temperatura da água.Portanto, a alternativa correta é D.Questão 67
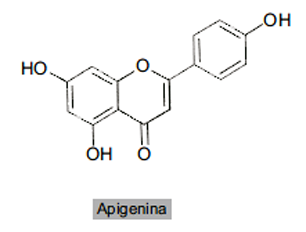 A apigenina é um ácido de _____________, pois possuigrupos funcionais ______________, doadores de _______________.Assinale a alternativa que completa corretamente aslacunas.A apigenina é um ácido de _____________, pois possuigrupos funcionais ______________, doadores de _______________.Assinale a alternativa que completa corretamente aslacunas.
A apigenina é um ácido de _____________, pois possuigrupos funcionais ______________, doadores de _______________.Assinale a alternativa que completa corretamente aslacunas.A apigenina é um ácido de _____________, pois possuigrupos funcionais ______________, doadores de _______________.Assinale a alternativa que completa corretamente aslacunas.- A) Lewis – hidroxilas – elétrons
- B) Lewis – fenóis – hidrogênios
- C) Brönsted-Lowry – fenóis – prótons
- D) Brönsted-Lowry – hidroxilas – elétrons
FAZER COMENTÁRIO- E) Brönsted-Lowry e Lewis – fenóis – prótons
A alternativa correta é letra C
Um ácido de Brönsted-Lowry é definido como uma espécie química que é doadora de prótons na forma do íon H+. Portanto, para que uma espécie química possa ser classificada como um ácido de Brönsted-Lowry, ela deve apresentar em sua estrutura, átomos de hidrogênio que sejam ionizáveis, ou seja, que possam ser liberados para outra espécie química como o íon H+.A Apigenina pode ser classificada como um ácido de Brönsted-Lowry porque apresenta átomos de H ionizáveis nas hidroxilas ligadas a anéis aromáticos, o que caracteriza os grupos funcionais fenóis, doadores de prótons.Assim, a alternativa correta é C.Questão 68
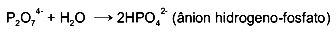 Se o ânion hidrogeno-fosfato receber mais dois hidrogênios,I – forma um triácido.II – o ácido formado se classifica como um hidrácido.III – o nome do ácido formado é ácido fosforoso.Está(ão) correta(s)
Se o ânion hidrogeno-fosfato receber mais dois hidrogênios,I – forma um triácido.II – o ácido formado se classifica como um hidrácido.III – o nome do ácido formado é ácido fosforoso.Está(ão) correta(s)- A) apenas I.
- B) apenas II.
- C) apenas III.
- D) apenas I e II.
FAZER COMENTÁRIO- E) apenas I e III.
A alternativa correta é letra A
A reação em questão (o ânion hidrogeno-fosfato recebendo mais dois hidrogênios) seria:2H+ + HPO4-2 → H3PO4Forma-se, desta forma, um triácido que tem por nome ácido fosfórico, o qual é um oxiácido.Analisando-se as afirmativas enunciadas, pode-se ver que a unica correta é I.Portanto, a alternativa correta é a letra A.Questão 69
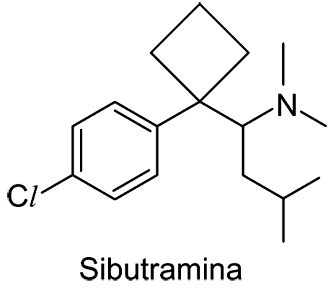 Com base nessa estrutura, pode-se afirmar que a sibutramina:
Com base nessa estrutura, pode-se afirmar que a sibutramina:- A) é uma base de Lewis, porque possui um átomo de nitrogênio que pode doar um par de elétrons para ácidos.
- B) é um ácido de Brönsted-Lowry, porque possui um átomo de nitrogênio terciário.
- C) é um ácido de Lewis, porque possui um átomo de nitrogênio capaz de receber um par de elétrons de um ácido.
- D) é um ácido de Arrhenius, porque possui um átomo de nitrogênio capaz de doar próton.
FAZER COMENTÁRIO- E) é uma base de Lewis, porque possui um átomo de nitrogênio que pode receber um par de elétrons de um ácido.
A alternativa correta é letra A
Para responder a esta questão, vamos utilizar as seguintes definições:Ácido de Lewis: É uma espécie química aceptora de pares de elétrons.Base de Lewis: É uma espécie química que doa pares de elétrons, para tanto deve ter ao menos um par de elétron não compartilhado.Ácido de Bronsted-Lowry: Espécie química doadora de íons H+.Base de Bronted-Lowry: Espécie química receptora de íons H+.Ácido de Arrhenius: Substâncias que em solução aquosa geram íons H+.Base de Arrhenius: Substâncias que em solução aquosa liberam íons OH-.Com bases nestas definições, podemos então analisar as proposições:a) é uma base de Lewis, porque possui um átomo de nitrogênio que pode doar um par de elétrons para ácidos. O átomo de N presente na estrutura realmente possui um par de elétron não compartilhado, podendo atuar como uma base de Lewis, pela definição.b) é um ácido de Brönsted-Lowry, porque possui um átomo de nitrogênio terciário. O fato de possuir um nitrogênio terciário não define a substância como um ácido. Essa classificação não está de acordo com a definição de um ácido de Bronsted-Lowry.c) é um ácido de Lewis, porque possui um átomo de nitrogênio capaz de receber um par de elétrons de um ácido. O átomo de nitrogênio da substância não está apto a receber par de elétron porque já possui seu octeto completo.d) é um ácido de Arrhenius, porque possui um átomo denitrogênio capaz de doar próton. O átomo de Nitrogênio da substância não pode atuar como ácido de Arrhenius porque não apresenta H ionizável ligado diretamente a ele.e) é uma base de Lewis, porque possui um átomo de nitrogênio que pode receber um par de elétrons de um ácido. Essa classificação não está de acordo com a definição de base de Lewis.Portanto, a alternativa correta é A.Continua após a publicidade..70) (ITA) Numa série de ácidos, chama-se de mais forte aquele que:
- A) reage mais rapidamente com metais;
- B) tem maior constante de dissociação;
- C) tem menor constante de dissociação;
- D) consome menos mols de NaOH por mol de ácido numa reação de neutralização;
FAZER COMENTÁRIO- E) consome mais mols de NaOH por mol de ácido numa reação de neutralização;
« Anterior 1 … 5 6 7 8 9 Próximo »A alternativa correta é letra B
A força de um ácido está relacionada com o grau de dissociação da molécula em meio aquoso. Quanto maior a constante de dissociação de um ácido maior a sua força ácida. Logo, a opção correta é a "B". - B) tem maior constante de dissociação;
- B) é um ácido de Brönsted-Lowry, porque possui um átomo de nitrogênio terciário.
- B) apenas II.
- B) Lewis – fenóis – hidrogênios
- B) I, II e III, apenas.
- B) NaCl + H2O → HCl + NaOH
- B) H2O;
- B) CH4
- B) NaOH;
