Questões Sobre Leis Ponderais - Química - 1º ano do ensino médio
1) O CaCO3 é um dos constituintes do calcário, importante matéria-prima utilizada na fabricação do cimento. Uma amostra de 7,50 g de carbonato de cálcio impuro foi colocada em um cadinho de porcelana de massa 38,40 g e calcinada a 900ºC, obtendo-se como resíduo sólido somente o óxido de cálcio. Sabendo-se que a massa do cadinho com o resíduo foi de 41,97 g, a amostra analisada apresenta um teor percentual de CaCO3 igual a Dados: massa molar em g/mol: Ca = 40; C = 12; O = 16.
- A) 70 %.
- B) 75 %.
- C) 80 %.
- D) 85 %.
FAZER COMENTÁRIO- E) 90 %.
A alternativa correta é letra D
A reação citada no enunciado é a seguinte.7,5 g de CaCO3 impuro foram adicionadas ao cadinho de 38,4 g de massa, totalizando 45,9 g.Após ser aquecido o cadinho passa a ter massa de 41,97g.Segundo a Lei de Lavoisier, durante uma reação as proporções são mantidas, do início ao fim da reação.A partir disso concluímos que foram formados 3,57g de CaO e 3,93g de CO2, que foi disperso no ar.Calculando a pureza do CACO3.
Calculando a porcentagem de impurezas:
Alternativa D.2) Em 1808, John Dalton propôs um modelo atômico no qual os átomos seriam minúsculas esperas indivisíveis e indestrutíveis. Átomos de diferentes elementos químicos teriam massas relativas diferentes, e átomos de um mesmo elemento químico teriam todos a mesma massa. Transformações químicas envolveriam rearranjos no modo como os átomos estão combinados.
- A) O fato de que, em certos sistemas, um dos reagentes se esgota (reagente limitant
- B), e o outro fica em excesso
- C) A conservação da massa total de um sistema fechado no qual ocorre transformação química.
- D) O fato de que as substâncias reagem entre si obedecendo a proporções definidas (lei de Proust)
- E) Fenômenos elétricos, como a condução de corrente elétrica por uma solução aquosa salina, por exemplo. FAZER COMENTÁRIO
A alternativa correta é letra D
O modelo de Dalton precisou ser modificado devido a descoberta dos íons, não sendo capaz de explicar a condução de eletricidade de uma solução aquosa salina , já que os mesmos átomos podem conduzir eletricidade quando estão em solução, e na forma sólida não (caso dos sais).Portanto, a resposta correta é a alternativa D.Questão 3
Esse enunciado é conhecido como Lei da Conservação das Massas ou Lei de Lavoisier. Na época em que foi formulado, sua validade foi contestada, já que na queima de diferentes substâncias era possível observar aumento ou diminuição de massa.Para exemplificar esse fenômeno, considere as duas balanças idênticas I e II mostradas na figura abaixo. Nos pratos dessas balanças foram colocadas massas idênticas de carvão e de esponja de aço, assim distribuídas:– pratos A e C: carvão;– pratos B e D: esponja de aço.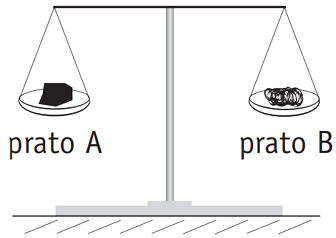
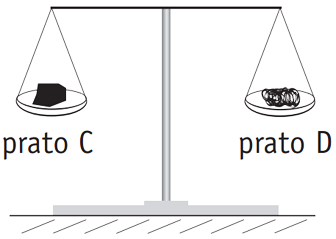 I IIA seguir, nas mesmas condições reacionais, foram queimados os materiais contidos em B e C, o que provocou desequilíbrio nos pratos das balanças.Para restabelecer o equilíbrio, serão necessários procedimentos de adição e retirada de massas, respectivamente, nos seguintes pratos:
I IIA seguir, nas mesmas condições reacionais, foram queimados os materiais contidos em B e C, o que provocou desequilíbrio nos pratos das balanças.Para restabelecer o equilíbrio, serão necessários procedimentos de adição e retirada de massas, respectivamente, nos seguintes pratos:- A) A e D
- B) B e C
- C) C e A
FAZER COMENTÁRIO- D) D e B
A alternativa correta é letra A
O carvão, quando queimado, sofre uma transformação química liberando gases para a atmosfera, tornando a peça de carvão mais leve do que anteriormente, na balança. Já a lã de aço aumenta sua massa quando queimada, devido ao ferro escaldante combinado com oxigênio. Assim, ao queimar B (palha de aço) e C (carvão), ocorrerá, respectivamente, aumento e redução de suas massas. Para se restabelecer o nível das balanças dever-se-á adicionar massa do prato A (carvão) e retirar massa do prato D (palha de aço). Portanto, a resposta é a alternativa A.4) Quando se aquece uma porção de esponja de aço, constituída principalmente por ferro (Fe), em presença de oxigênio do ar, ela entra em combustão formando óxido de ferro (III) como único produto. Logo, se 1 g de esponja de aço for aquecido e sofrer combustão total, a massa do produto sólido resultante será
FAZER COMENTÁRIO- A) menor do que 1 g, pois na combustão forma-se também CO2(g).
- B) menor do que 1 g , pois o óxido formado é muito volátil.
- C) igual a 1 g, pois a massa se conserva nas transformações químicas.
- D) maior do que 1 g, pois o ferro é mais denso do que o oxigênio.
- E) maior do que 1 g, pois átomos de oxigênio se ligam aos de ferro.
A alternativa correta é letra E
Traduzindo o enunciado da questão, para uma equação da reação, tem-se a seguinte reação de oxidação do Fe0 (s) a Fe3+.2Fe0(s) + 3/2O2(g) → Fe2O3(s)Como, foi informado que a esponja de aço é igual a 1g e esta é constituída principalmente por ferro (Fe). Aplicando a Lei de Lavoisier (Lei da conservação das massas), em que esta nos diz que numa reação química num sistema fechado, a massa permanece constante, ou seja, m reagentes = m produtos , tem-se que:
mreagentes = 1 g + 1 g (considera-se mesma massa de oxigênio para exemplificar) e mprodutos = 2g.
Portanto, a massa de Fe2O3 é maior 1 g, pois na sua composição química não tem somente ferro mas, também oxigênio. Alternativa E.Questão 5
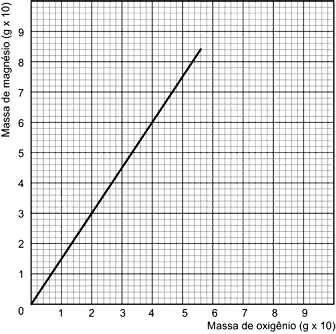 Considere os reagentes em extrema pureza e reação completa. A análise desse gráfico permite afirmar queFAZER COMENTÁRIO
Considere os reagentes em extrema pureza e reação completa. A análise desse gráfico permite afirmar queFAZER COMENTÁRIO- A) as massas de oxigênio e magnésio, envolvidas nas reações, são inversamente proporcionais.
- B) a massa de oxigênio, necessária para reagir com 48 g de magnésio, é de 4,8 g.
- C) usando-se 60 g de magnésio e 60 g de oxigênio, formam-se 100 g de óxido de magnésio, havendo um excesso de 20 g de oxigênio.
- D) usando-se 60 g de magnésio e 60 g de oxigênio, formam-se 120 g de óxido de magnésio.
- E) a proporção entre as massas de magnésio e oxigênio que reagem para formar óxido de magnésio é de 2 de Mg para 3 de O.
A alternativa correta é letra C
A reação de Magnésio com oxigênio é representada por:Alternativa (a) - Incorreta, pois são diretamente proporcionais, de acordo com os dados do gráfico e com a equação da reação, aumentando a quantidade de massa de magnésio é necessário maior massa de oxigênio para formar o óxido de magnésio.Alternativa (b) - Incorreta, pois interpolando no gráfico 2x 10g de oxigênio reagem com 3 x 10g de magnésio. A proporção da reação é 2 (Oxigênio): 3(Magnésio). Então 2x10g de O2 –––– 3x10g de MagnésioX –––– 48g de MagnésioX=32g de O2Alternativa (c) - Correta, pois de acordo com a relação2x10g de O2 –––– 3x10g de MgX –––– 60g de MagnésioX=40g de O2Para formar 100g de Óxido de Magnésio necessita-se de 60g de Magnésio e de 40g de Oxigênio.(60g de Magnésio –––– 40g de O2––– 100g de óxido de Magnésio)- (Lei de Lavoisier - conservação das massas), como foi utilizado 60g de Oxigênio 20g está em excesso.Alternativa (d) - Incorreta, pois como mostrado na alternativa anterior 60g de Magnésio reagem com 40g de oxigênio , adicionando maior quantidade de oxigênio só promove um excesso do mesmo e não maior produção de Óxido de Magnésio.Alternativa (e) - Incorreta, pois como está demonstrado na alternativa b esta proporção é de 2 de Oxigênio:3 de Magnésio6) Um frasco contendo 1,0 L de água oxigenada de concentração 1,0 mol/L foi armazenado incorretamente e verificou-se a eliminação de 8 g de O2. Sabendo-se que na decomposição de água oxigenada são produzidos H2O e O2, a porcentagem de água oxigenada decomposta é igual a
FAZER COMENTÁRIO- A) 50
- B) 25
- C) 10
- D) 8
A alternativa correta é letra B
A água oxigenada (H2O2) possui massa molar de 34 g/mol. Se temos 1 mol/L, temos 34 g/L de H2O2 nesta solução. A sua decomposição causa a liberação de O2. O gás oxigênio possui massa molar de 32 g/mol. Logo se toda a água oxigenada fosse decomposta, teríamos 32 g de O2, pois a decomposição de 1 mol de H2O2 gera 1 mol de O2. Como a massa foi um quarto, conclui-se que 25% da água oxigenada foi decomposta. Portanto, a resposta correta é a alternativa B.7) A porcentagem ponderal de enxofre existente no SO2 é igual a:
- A) 2,0
- B) 16,0
- C) 32,0
- D) 33,3
FAZER COMENTÁRIO- E) 50,0
A alternativa correta é letra E
Analisando as massas atômicas do oxigênio e do enxofre, tem-se, respectivamente, 16 e 32 u.m.a.Com isso, chega-se que a massa molecular do SO2 é de 64 u.m.a.A porcentagem ponderal de enxofre no óxido em questão equivale a:100. 32/64 = 50%Portanto, a resposta correta é a alternativa E.8) Em que Lavoisier atribuía relevâncias ao dizer que tinha fé em sua balança?
- A) Modelos
- B) Teoria
- C) Experimentos
- D) Proporções
FAZER COMENTÁRIO- E) Conclusões
A alternativa correta é letra C
Ao afirmar que tinha fé em sua balança, Lavoisier atribuía relevância aos experimentos realizados por ele. Tal afirmação decorre do fato de Lavoisier ter constatado de forma experimental que, num sistema fechado, a soma das massas dos reagentes com as massas dos produtos era constante. Ou seja, com base nestes experimentos Lavoisier pôde constatar que a Lei da Conservação das Massas, cujo enunciado afirma que não há criação ou destruição da matéria - apenas há conversão de uma forma em outra, era verdadeira.Portanto, a alternativa correta é C.Questão 9
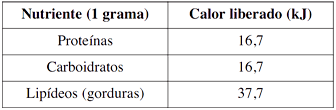
- A) 2
- B) 3
- C) 6
- D) 9
FAZER COMENTÁRIO- E) 12
A alternativa correta é letra D
Inicialmente, devemos saber a quantidade de cada um dos nutrientes citados, com base nas porcentagens citadas no enunciado, para 100 g de sorvete. 5% de proteínas em 100 g de sorvete são 5 g de proteínas. 22% de carboidratos em 100 g de sorvete são 22 g de carboidratos. 13% de gorduras em 100 g de sorvete são 13 g de gorduras. O segundo passo é usar os valores de calor liberado por grama de cada um dos nutrientes e multiplicar pela pelas massas de cada um deles em 100 g de sorvete, conforme segue:Proteínas:Carboidratos:Gorduras:O último passo requer a soma do calor liberado total para cada um dos nutrientes e dividir o valor energético diário recomendável para uma criança por este valor. O calor liberado pelos três nutrientes em 100 g de sorvete será:E a quantidade de sorvetes de 100 g necessários:Assim, serão necessários aproximadamente 9 sorvetes de 100 g para suprir a demanda diária de uma criança. Portanto, a resposta correta é a alternativa D.Continua após a publicidade..10) Qual é a massa de água (H2O) obtida na combustão completa de 88 g de gás propano (C3H8)?
- A) 44g.
- B) 22g.
- C) 72g.
- D) 88g.
FAZER COMENTÁRIO- E) 144 g.
1 2 Próximo »A alternativa correta é letra E
Considerando-se, de acordo com a lei de Proust, que numa reação química há uma proporção constante entre as massas das substâncias partcipantes, podemos considerar as seguintes relações:A proporção em mols entre C3H8 e H2O é de 1:4. Considerando-se essa proporção em massa, temos que 44g de C3H8 (massa de 1 mol) produzem 72g de H2O (massa de 4 mols).Visto que, pela lei de Proust, há uma proporção em massa entre os reagentes e produtos de uma reação, ao utilizarmos uma massa de 88g de C3H8 ( 44g x 2) sabemos que serão produzidos 144 g de H2O (72g x 2).Alternativa correta, E. - B) 22g.
- B) 3
- B) Teoria
- B) 16,0
- B) B e C
- C) A conservação da massa total de um sistema fechado no qual ocorre transformação química.
- B) 75 %.
