Questões Sobre Ligações Químicas - Química - 1º ano do ensino médio
Questão 21
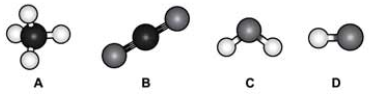
Analise a polaridade dessas moléculas, sabendo que tal propriedade depende da
• diferença de eletronegatividade entre os átomos que estão diretamente ligados. (Nas moléculas apresentadas, átomos de elementos diferentes têm eletronegatividades diferentes.)
• forma geométrica das moléculas.
Observação: Eletronegatividade é a capacidade de um átomo para atrair os elétrons da ligação covalente.
• forma geométrica das moléculas.
Observação: Eletronegatividade é a capacidade de um átomo para atrair os elétrons da ligação covalente.
Dentre essas moléculas, pode-se afirmar que são polares apenas
- A) A e B
- B) A e C
- C) A, C e D
- D) B, C e D
FAZER COMENTÁRIO- E) C e D
A alternativa correta é letra E
O efeito da eletronegatividade sobre as moléculas é que os elétrons compartilhados não se distribuem de maneira igual sobre os átomos. Os átomos mais eletronegativos trazem os elétrons para perto de si e acumulam em sua proximidade suas cargas elétricas negativas. Por consequência, os átomos menos eletronegativos ficam mais distantes dos elétrons e na vizinhança deles as cargas positivas tendem a predominar. O resultado é que as moléculas que apresentam essa característica desenvolvem dois polos elétricos, um negativo, próximo ao átomo mais eletronegativo onde os elétrons se concentram, e outro positivo, próximo ao átomo menos eletronegativo, que fica distante dos elétrons. Além disso, existe o efeito da estrutura das moléculas, as moléculas simétricas acabam tendo um momento de dipolo igual a zero, ou seja, são apolares pelo fato das cargas se anularem. Assim, as moléculas representadas por A (CH4) e B (CO2), são simétricas e, portanto, apolares. A molécula representada por D (HCl) é constituída por dois átomos diferentes, sendo o cloro um dos átomos mais eletronegativos, logo, este atrai os elétrons para si, formando um momento dipolar negativo sobre este e o hidrogênio, que fica pobre em elétrons, apresenta um momento dipolar positivo. Pela diferença de cargas, esta é uma molécula polar. Já a molécula C (H2O) é polar pois os elétrons tendem a se concentrar próximos do elemento eletronegativo, o oxigênio, formando uma carga dipolo negativa sobre este e uma carga dipolo positiva sobre os átomos de hidrogênio. Como esta apresenta uma estrutura angular, os momentos de dipolo não se anulam e a molécula apresenta um momento dipolar diferente de zero, sendo polar. Dessa forma, a alternativa que apresenta moléculas polares é a E.22) A polaridade de substâncias orgânicas é consequência tanto da geometria molecular quanto da polaridade das ligações químicas presentes na molécula. Indique a alternativa que contém apenas substâncias apolares.
- A) Acetileno e álcool etílico.
- B) Álcool etílico e etano.
- C) Tetracloreto de carbono e etano.
- D) Metano e cloreto de metila.
FAZER COMENTÁRIO- E) Tetracloreto de carbono e cloreto de metila.
A alternativa correta é letra C
Considerando que compostos apolares são todos aqueles que não apresentam pólos, ou seja, não apresentam diferenças de eletronegatividade significativas, temos, dentre as alternativas, como possíveis compostos apolares, apenas o acetileno, eteno e tetracloreto de carbono. Os "pólos" destes compostos são mostrados na figura abaixo: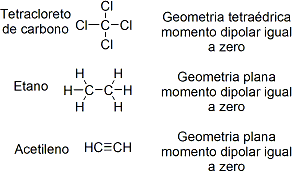 Assim, a alternativa "C", que lista o tetracloreto de carbono e o etano, é a correta.
Assim, a alternativa "C", que lista o tetracloreto de carbono e o etano, é a correta.Questão 23
Existem três compostos diclorobenzeno diferentes de fórmula molecular C6H4Cl2, que diferem em relação às posições dos átomos de cloro no anel benzênico, conforme as figuras 1, 2 e 3.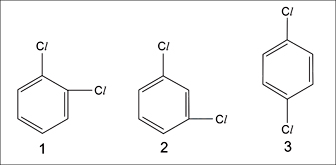 Das três figuras, é polar a fórmula apresentada em
Das três figuras, é polar a fórmula apresentada em- A) 3, somente.
- B) 1 e 2, somente.
- C) 1 e 3, somente.
- D) 2 e 3, somente.
FAZER COMENTÁRIO- E) 1, 2 e 3.
A alternativa correta é letra B
A posição dos átomos de cloro será determinante para definir a polaridade das moléculas pois, se estes estiverem em posições simétricas os momentos de dipolo se anularão e a molécula será apolar, com momento de dipolo igual a zero. Analisando as três estruturas, temos: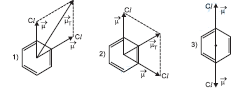 Portanto, as figuras 1 e 2 apresentam um momento de dipolo diferente de zero, , sendo ambas polares e a figura 3 apresenta um momento de dipolo igual a zero , pois os vetores se anulam, sendo apolar.
Portanto, as figuras 1 e 2 apresentam um momento de dipolo diferente de zero, , sendo ambas polares e a figura 3 apresenta um momento de dipolo igual a zero , pois os vetores se anulam, sendo apolar.24) As moléculas Cl2, HI, C4H10 e NaCl são respectivamente:
FAZER COMENTÁRIO- A) polar, apolar, polar e polar.
- B) apolar, polar, apolar e polar.
- C) polar, polar, apolar e apolar.
- D) apolar, polar, polar e apolar.
- E) polar, polar, apolar e polar.
A alternativa correta é letra B
Uma determinada molécula pode ser classificada como polar se apresenta as seguintes características:
- Apresenta uma ou mais ligações polares, ou seja, ligações entre átomos de diferentes eletronegatividades;
- Mesmo formada por ligações polares, a molécula polar deve apresentar também uma geometria tal que permita a concentração da nuvem eletrônica numa determinada região da mesma (pólo negativo), e um défcit de carga eletrônica em outra região (pólo positivo).
Por comparação, podemos concluir que uma molécula apolar é aquela em que as polaridades das ligações individuais se anulam.Com base em tais definições, podemos analisar cada uma das moléculas citadas:Cl2 - Formado por uma ligação simples Cl-Cl, esta molécula é apolar, pois a nuvem eletrônica encontra-se igualmente dividida entre os dois átomos de igual eletronegatividade.HI - A molécula HI deverá ser polar, porque é formada por uma ligação H-I em que o I, de maior eletronegatividade, atrai para si a nuvem eletrônica que forma a ligação química. O resultado é que o I apresenta uma carga parcial negativa e o H, mais deficiente em carga eletrônica, apresenta carga parcial positiva.C4H10 - Apesar de ser constituída por ligações apolares C-C e por ligações ligeiramente polares C-H, a geometria da molécula permite o anulamento dos vetores que representam a polaridade das ligações, de modo que a polaridade total da molécula é nula, ou seja, a molécula éapolar.NaCl - Esta substância é formada por uma ligação iônica, ou seja, é formada pela interação entre um íon positivo (cátion Na+) e um íon negativo (ânion Cl-). Ou seja, essa é uma substância polar, em que seus componentes apresentam cargas reais 1+ e 1-.Portanto, a alternativa correta é B.25) O efeito estufa resulta principalmente da absorção da radiação infravermelha, proveniente da radiação solar, por moléculas presentes na atmosfera terrestre. A energia absorvida é armazenada na forma de energia de vibração das moléculas. Uma das condições para que uma molécula seja capaz de absorver radiação infravermelha é que ela seja polar. Com base apenas neste critério, dentre as moléculas O2, N2 e H2O, geralmente presentes na atmosfera terrestre, contribuem para o efeito estufa:
- A) O2, apenas.
- B) H2O, apenas.
- C) O2 e N2, apenas.
- D) H2O e N2, apenas.
FAZER COMENTÁRIO- E) N2, apenas.
A alternativa correta é letra B
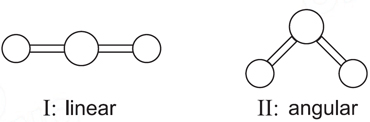
Para resolver esta questão precisamos decidir o momento de dipolo de cada uma das moléculas citadas. O oxigênio (O2) e o nitrogênio (N2) são moléculas lineares, compostas por dois elementos de igual polaridade, estes momentos de dipolo se cancelam tornando-se nulos, portanto essas moléculas são apolares. A água (H2O) é uma molécula angular, seu momento de dipolo não se cancela, sendo esta uma molécula polar. De acordo com o texto uma das condições para uma molécula absorver radiação infravermelha é ela ser polar e a única molécula polar dentre as citadas é a água. Portanto, a resposta correta é a alternativa B.26) Indique o par em que ambas as substâncias sejam polares:
- A) H2O e CO2
- B) CCl4 e CH4
- C) SO2 e CH4
- D) H2O e CCl3H
FAZER COMENTÁRIO- E) CH4 e H2O
A alternativa correta é letra D
Moléculas polares são aquelas que apresentam um momento de dipolo diferente de zero. Moléculas apolares possuem o momento de dipolo elétrico igual a zero. Em moléculas que possuem átomos iguais em posições opostas, como no CO2, SO2, CH4 e CCl4, os vetores se anulam e o momento de dipolo é igual a zero. Já nas moléculas de H2O e CCl3H, os vetores não se anulam e o momento de dipolo é diferente de zero. Assim, temos: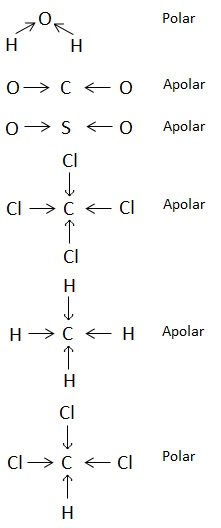
Questão 27
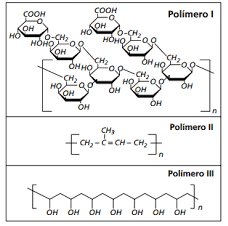
Para remover os resíduos de polímero das peças, o funcionário dispunha de apenas dois solventes: água e n-hexano. O funcionário analisou as fórmulas estruturais dos três polímeros e procurou fazer a correspondência entre cada polímero e o solvente mais adequado para solubilizá-lo. A alternativa que representa corretamente essa correspondência é:FAZER COMENTÁRIO- A)

- B)

- C)

- D)
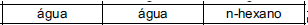
- E)

A alternativa correta é letra A
Na remoção de resíduos, o que governa a afinidade dos mesmo com os solventes utilizados é a polaridades das substâncias envolvidas. Resíduos polares requerem a utilização de solventes polares para sua remoção. Resíduos apolares requerem a utilização de solventes apolares. Dos três polímeros observados, nota-se que os polímeros I e III possuem grupos hidroxila ligados ao carbono, tornando-os polar. Dessa forma o solvente mais adequado a se utilizar é a água, um composto polar. O polímero II é um hidrocarboneto e, portanto, apolar. Dessa forma, o solvente utilizado deve ser apolar, nesse caso, o hidrocarboneto n-hexano. Portanto, a resposta correta é a alternativa A.Questão 28
 Considere as seguintes afirmações, sobre esses exemplos de reagentes.I – Todos os carbonos do composto 1 apresentam geometria trigonal-plana.II – No composto 2, o boro apresenta geometria tetraédrica.III – No composto 3, dois carbonos apresentam geometria linear, e um carbono apresenta geometria tetraédrica.Quais estão corretas?
Considere as seguintes afirmações, sobre esses exemplos de reagentes.I – Todos os carbonos do composto 1 apresentam geometria trigonal-plana.II – No composto 2, o boro apresenta geometria tetraédrica.III – No composto 3, dois carbonos apresentam geometria linear, e um carbono apresenta geometria tetraédrica.Quais estão corretas?- A) Apenas II.
- B) Apenas III.
- C) Apenas I e II.
- D) Apenas I e III.
FAZER COMENTÁRIO- E) I, II e III.
A alternativa correta é letra D
Analisando cada afirmação:I está correta. Pois, todos os carbonos com uma ligação dupla e duas simples são trigonais planos.II está incorreta. Pois, o boro é trigonal plano.III está correta. Pois, os carbonos com ligação tripla são lineares e o carbono da metila é tetraédrico.
Portanto, a alternativa correta é a letra D.Questão 29
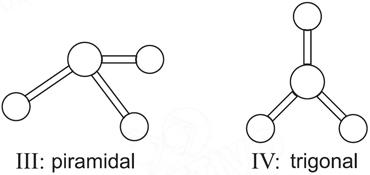 SO3, H2S e BeCl2 apresentam, respectivamente, as geometrias molecularesFAZER COMENTÁRIO
SO3, H2S e BeCl2 apresentam, respectivamente, as geometrias molecularesFAZER COMENTÁRIO- A) III, I e II.
- B) III, I e IV.
- C) III, II e I.
- D) IV, I e II.
- E) IV, II e I.
A alternativa correta é letra E
A molécula de H2S pode ser representada pela estrutura II, haja visto que o S possui 2 pares de elétrons não-ligantes que se repulsam e conferem a geometria angular a esta molécula. A molécula de SO3 é representada pela estrutura IV, onde o S possui 3 pares de elétrons ligados ao O. Já na molécula de BeCl2 , o Be possui os 2 pares de elétrons ligados a dois Cl, sendo representado pela geometria linear.Continua após a publicidade..Questão 30
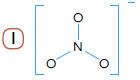
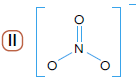
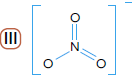
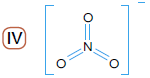 A fórmula que corresponde ao íon nitrato está identificada pelo seguinte número:FAZER COMENTÁRIO
A fórmula que corresponde ao íon nitrato está identificada pelo seguinte número:FAZER COMENTÁRIO- A) I.
- B) II.
- C) III.
- D) IV.
A alternativa correta é letra B
A fórmula iônica do íon nitrato é NO3- . Em sua fórmula estrutural, os três átomos de oxigênio estão ligados ao átomo de nitrogênio. Pela distribuição eletrônica dessas substâncias, sabe-se que o nitrogênio apresenta cinco elétrons em sua última camada, enquanto o oxigênio apresenta seis.
De acordo com regra do octeto, para adquirir estabilidade com oito elétrons em sua camada de valência, o nitrogênio irá formar uma ligação dupla com o primeiro dos átomos de oxigênio (que também irá adquirir estabilidade) e uma ligação simples com um segundo átomo de oxigênio. Por ser um ânion de carga –1, o nitrato contém mais um elétron dos que os presentes nos átomos participantes. Esse elétron se liga ao segundo átomo de oxigênio, proporcionando assim sua estabilidade.
Resta ainda o terceiro átomo de oxigênio, que necessita de dois elétrons para alcançar a estabilidade. Como o nitrogênio já completou sua última camada, uma ligação covalente dativa entre o nitrogênio e o terceiro oxigênio é formada, utilizando dois elétrons livres do átomo de nitrogênio.
Com base nessas informações, a fórmula estrutural do ânion nitrato é representada por: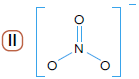
- B) Apenas III.
- B) CCl4 e CH4
- B) H2O, apenas.
- B) 1 e 2, somente.
- B) Álcool etílico e etano.
- B) A e C
