Questões Sobre Ligações Químicas - Química - 1º ano do ensino médio
Questão 31
(www.escuelaintegral.edu.uy)
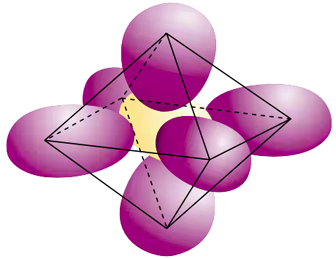
Considere que a distância entre o centro de um átomo de flúor e o centro do átomo de enxofre seja igual a 1,53 oA.
Assim, a medida da aresta desse octaedro, em oA, é aproximadamente igual a:
Assim, a medida da aresta desse octaedro, em oA, é aproximadamente igual a:
- A) 1,53
- B) 1,79
- C) 2,16
- D) 2,62
A alternativa correta é letra C
Apesar de envolver a geometria molecular do composto citado, esta questão pode ser resolvida apenas com conhecimentos de geometria espacial.
Sendo a molécula um octaedro regular, é formado por uma base quadrada e por triângulos equiláteros que se unem formando o poliedro representado na figura.
Sabendo-se que os centros dos átomos de flúor estão localizados nos vértices do octaedro e que o centro do enxofre corresponde ao centro (centro da base quadrada) desta figura, podemos calcular o que se pede.
A distância entre o centro de um átomo de flúor e o centro do átomo de enxofre corresponde à metade da diagonal do quadrado. Ou seja, a diagonal do quadrado que forma a base da figura é 2 x 1,53 oA, igual a 3,06°A.
Considerando-se a figura ilustrativa abaixo, temos a base quadrada do octaedro e um dos triângulos (todos são iguais, num total de oito triângulos) que formam os lados do octaedro.
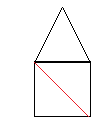
Para o quadrado, todos os lados são iguais e considerando o triângulo retângulo formado por dois lados consecutivos (l) deste quadrado e sua diagonal (d), temos:
Sendo a molécula um octaedro regular, é formado por uma base quadrada e por triângulos equiláteros que se unem formando o poliedro representado na figura.
Sabendo-se que os centros dos átomos de flúor estão localizados nos vértices do octaedro e que o centro do enxofre corresponde ao centro (centro da base quadrada) desta figura, podemos calcular o que se pede.
A distância entre o centro de um átomo de flúor e o centro do átomo de enxofre corresponde à metade da diagonal do quadrado. Ou seja, a diagonal do quadrado que forma a base da figura é 2 x 1,53 oA, igual a 3,06°A.
Considerando-se a figura ilustrativa abaixo, temos a base quadrada do octaedro e um dos triângulos (todos são iguais, num total de oito triângulos) que formam os lados do octaedro.

Para o quadrado, todos os lados são iguais e considerando o triângulo retângulo formado por dois lados consecutivos (l) deste quadrado e sua diagonal (d), temos:
Teorema de Pitágoras
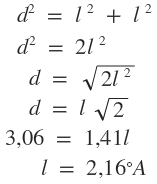
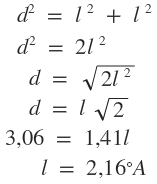
Portanto, com base neste cálculo e na figura ilustrativa, podemos concluir que o lado do quadrado que compõe a base da figura é igual ao lado (ou aresta) de todos os triângulos que formam o octaedro.
Assim, a medida da aresta desse octaedro, em oA, é aproximadamente igual a 2,16 ºA.
Alternativa correta, C.
Questão 32
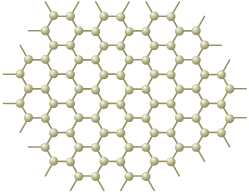
O número de ligações duplas realizadas por átomo em um nanotubo corresponde a:
- A) 1.
- B) 2.
- C) 3.
- D) 4.
A alternativa correta é letra A
No esquema, cada núcleo atômico estabelece três ligações com outros núcleos. Sabe-se que não estão representadas as ligações do tipo pi. Logo, as três ligações indicados são do tipo sigma. Como o átomo de carbono é tetravalente, isto é, forma quatro ligações, a quarta ligação é do tipo pi. Essa configuração corresponde a um átomo de carbono com hibridação do tipo sp2.
Analisando-se as ligações formadas pelo átomo de carbono, verifica-se que são formadas duas ligações simples e apenas uma ligação dupla.
Analisando-se as ligações formadas pelo átomo de carbono, verifica-se que são formadas duas ligações simples e apenas uma ligação dupla.
33) Relacione a fórmula, forma geométrica e polaridade a seguir, assinalando a opção CORRETA:
- A) CO2 linear polar
- B) CCl4 tetraédrica polar
- C) NH3 piramidal apolar
- D) BeH2 linear apolar
FAZER COMENTÁRIO- E) SO angular apolar
A alternativa correta é letra D
A forma geométrica de uma molécula está diretamente relacionada com a quantidade de pares eletrônicos disponíveis e a quantidade de ligantes no átomo principal.E a polaridade está relacionada com a geometria molecular, visto que esta determina a presença ou não de um dipolo na molécula.Dentre as opções, as associações corretas são a do berílio, que apresenta a exceção de se estabilizar com 6 elétrons na camada de valência, assim, o BeH2 apresenta geometria linear e não tem polaridade.Portanto, a resposta correta é a alternativa D.34) As moléculas BF3 e NH3 apresentam, respectivamente, geometrias:
- A) piramidal e tetraédrica.
- B) tetraédrica e plana.
- C) trigonal e piramidal.
- D) piramidal e piramidal.
FAZER COMENTÁRIO- E) trigonal e trigonal.
A alternativa correta é letra C
A geometria molecular diz respeito à posição espacial dos átomos que compõem uma molécula. Pode-se fazer uma previsão da geometria molecular a partir da quantidade de nuvens eletrônicas (pares de elétrons compartilhados e não - compartilhados) ao redor do átomo central desta molécula. Para tanto, considera-se que as nuvens eletrônicas repelem-se mutuamente, de modo que, se encontram no espaço à maior distância angular possível umas das outras.Geometria molecular do BF3: O elemento químico boro (B) pertence à familia 3A da tabela periódica. Isto significa que o B possui três elétrons na camada de valência e, diferentemente da maioria dos elementos químicos, atinge a estabilidade com apenas 6e- na camada de valência. Assim, ao redor do átomo central B, há três nuvens eletrônicas (pares de elétrons compartilhados com os três átomos de F). A maior distância angular possível entre três nuvens eletrônicas ao redor de um átomo central é de 120°. Essa geometria é denominada trigonal plana ou triangular.Geometria molecular do NH3: O átomo central desta molécula, o nitrogênio (N), pertence à família 5A da tabela periódica, ou seja, possui um total de 5e- na camada de valência, fazendo três ligações para atingir a establilidade proveniente do octeto (8e- na camada de valência) completo. Assim, ao redor do átomo central há quatro nuvens eletrônicas: 3 pares de elétrons compartilhados com átomos de H e 1 par de elétrons não - compartilhados. A geometria molecular resultante deste arranjo espacial é denominada piramidal.Portanto, a alternativa correta é C.Questão 35
 FAZER COMENTÁRIO
FAZER COMENTÁRIO- A) linear.
- B) angular.
- C) trigonal.
- D) piramidal.
- E) tetraédrica.
A alternativa correta é letra A
Devido à eletronegatividade dos dois átomos de Oxigênio fazer com que sofram forças de atração e de repulsão de mesma intensidade com o átomo de carbono, sua geometria é linear.36) As geometrias das moléculas PH3 e H2S são respectivamente:
- A) trigonal plana e linear;
- B) tetraédrica e linear;
- C) piramidal trigonal e angular;
- D) quadrada plana e triangular plana;
FAZER COMENTÁRIO- E) tetraédrica e trigonal plana.
A alternativa correta é letra C
Realizando a distribuição eletrônica do fósforo e do enxofre, chega-se que possuem, respectivamente, 5 e 6 elétrons na camada de valência. O fósforo possui então 3 elétrons individuais e um par, e no PH3, cada hidrogênio se liga em um desses elétrons individuais, conferindo, então, uma geometria piramidal (quatro pares de elétrons e três ligantes).Já no enxofre, há dois elétrons individuais e dois pares, e no H2S, cada hidrogênio se liga nesses dois elétrons individuais, conferindo uma geometria angular (quatro pares e dois ligantes).Portanto, a resposta correta é a alternativa C.37) Com relação à geometria das moléculas, a opção correta a seguir é:
FAZER COMENTÁRIO- A) NO – linear, CO2 – linear, NF3 – piramidal, H2O – angular , BF3 – trigonal plana.
- B) NO – linear, CO2 – angular, NF3 – piramidal, H2O – angular , BF3 – trigonal plana.
- C) NO – linear, CO2 – trigonal, NF3 – trigonal, H2O – linear, BF3 – piramidal.
- D) NO – angular, CO2 – linear, NF3 – piramidal, H2O – angular , BF3 – trigonal.
- E) NO – angular, CO2 – trigonal, NF3 – trigonal, H2O – linear, BF3 – piramidal.
A alternativa correta é letra A
A geometria de uma molécula pode ser identificada com base em pelo menos dois fatores: quantidade de nuvens eletrônicas (pares de elétrons compartilhados e não-compartilhados) ao redor do átomo central e tipo de ligação entre os átomos que compõem tal molécula.Com base na teoria da repulsão dos pares eletrônicos, as nuvens eletrônicas ao redor de um átomo central estão localizadas no espaço de modo a minimizar as repulsões mútuas entre as mesmas. Desta forma, a depender da quantidade de nuvens eletrônicas, as moléculas poderão apresentar diferentes geometrias.Analisando-se as moléculas citadas:NO: Esta molécula biatômica, assim como todas as moléculas biatômicas, apresenta geometria plana, ou linear.CO2: O dióxido de carbono é formado por duas ligações duplas C=O. A ligação dupla orienta os átomos envolvidos numa geometria linear, pois é necessário que os átomos estejam num mesmo plano para que essa ligação possa ocorrer.NF3: O átomo central desta molécula, o nitrogênio (N), pertence à família 5A da tabela periódica, indicando que este elemento apresenta um total de 5e- na camada de valência, precisando de 3e- para atingir a estabilidade do octeto (8e- na camada de valência) completo. Assim, na molécula de NF3 há um total de quatro nuvens eletrônicas ao redor deste átomo central: 3 pares de elétrons compartilhados com átomos de F e 1 par de elétrons não-compartilhados. A geometria molecular decorrente deste tipo de arranjo geométrico é piramidal.H2O: Na molécula de água, o átomo central é o oxigênio (O). Por pertencer à família 6A da tabela periódica, o átomo de O precisa de apenas duas ligações para adquirir estabilidade. Portanto, há um total de três nuvens eletrônicas ao redor do átomo central, sendo duas correspondentes aos pares de elétrons das ligações O - H e um par de elétrons não-compartilhados. Assim, com base nesse arranjo, pode-se inferir que a geometria desta molécula é angular.BF3: O boro, diferentemente da maioria dos elementos químicos, apresenta três elétrons na camada de valência, mas atinge a estabilidade com apenas 6e- na última camada eletrônica. Deste modo, na molécula de BF3 não há pares de elétrons não-compartilhados ao redor do átomo de B. As três nuvens eletrônicas são correspondentes às três ligações iguais B - F. A melhor geometria de modo a minimizar as repulsões entre estas nuvens é a geometria trigonal plana ou triangular.Alternativa correta, A.Questão 38
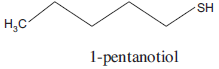 Assinale a alternativa que apresenta corretamente a geometria molecular do gás sulfídrico e a fórmula molecular do 1-pentanotiol.FAZER COMENTÁRIO
Assinale a alternativa que apresenta corretamente a geometria molecular do gás sulfídrico e a fórmula molecular do 1-pentanotiol.FAZER COMENTÁRIO- A) Angular e C5H4S.
- B) Linear e CH4S.
- C) Angular e CH4S.
- D) Angular e C5H12S.
- E) Tetraédrica e C5H12S.
A alternativa correta é letra D
Considere para o gás sulfídrico (H2S) as seguintes distribuições eletrônicas:
1H: 1s1
16S: 1s2 2s2 2p6 3s2 3p4
De acordo com a teoria da repulsão dos pares de elétrons, a molécula H2S é angular, devido a presença de quatro pares de elétrons não ligantes no S, que se dirigem para os vértices de um tetraedro contendo apenas dois átomos em dois vértices. O composto ilustrado na figura tem a seguinte fórmula estrutural:H3C — CH2 — CH2 — CH2 — CH2 — SHPortanto, terá a fórmula molecular: C5H12S. Assim, a resposta correta é a alternativa D.39) Tomando-se por base apenas a disposição dos átomos, podemos afirmar que as moléculas C2H2, H2O, CH4, e C2H4 são respectivamente:
FAZER COMENTÁRIO- A) Polar, linear, tetraédrica e angular.
- B) Linear, angular, tetraédrica e plana.
- C) Tetraédrica, angular, plana e tetraédrica.
- D) Linear, angular, plana e tetraédrica.
- E) Angular, linear, tetraédrica e plana
A alternativa correta é letra B
Considerando-se a teoria da repulsão dos pares eletrônicos, é possível constatar que as nuvens eletrônicas (pares de elétrons compartilhados e não-compartilhados) ao redor de um átomo central de uma molécula repelem umas às outras, resultando em geometrias moleculares em que tais nuvens estão à maior distância angular umas das outras, de modo a minimizar tais repulsões. Vale salientar que a geometria molecular varia a depender do número de nuvens eletrônicas e do tipo de ligação ao redor do átomo central.A partir da disposição dos átomos no espaço, com base no posicionamento e na quantidade de nuvens eletrônicas ao redor do átomo central, podemos inferir a geometria das moléculas citadas:C2H2: O etino, ou acetileno, é o alcino de estrutura mais simples possível. Os átomos de carbono estão ligados através de uma ligação tripla C≡C. A presença da ligação tripla necessáriamente orienta a molécula para uma geometria plana ou linear, uma vez que este tipo de ligação só ocorre se os dois átomos envolvidos estiverem num mesmo plano.H2O: Na molécula da água, observa-se que o átomo central, O, apresenta um total de três nuvens eletrônicas ao seu redor: dois pares de elétrons compartilhados com átomos de H e um par de elétrons não compartilhados. A repulsão entre tais nuvens resulta numa geometriaangular. Tal geometria é resultado da maior repulsão causada pelo par de elétrons não compartilhado, aproximando as duas ligações O - H.CH4: O átomo de carbono do metano apresenta quatro nuvens eletrônicas iguais ao seu redor, formadas pelos quatro pares de elétrons envolvidos nas ligações C - H. A melhor distância angular entre tais nuvens é obtida quando cada uma das quatro ligações estão dirigidas para os vértices de um tetraedro, resultando numa geometria denominada tetraédrica.C2H4: A geometria molecular do eteno, ou etileno, é semelhante à geometria do etino. A ligação dupla C = C do eteno também orienta a molécula para um arranjo espacial plano ou linear, a fim de que a ligação dupla possa ser efetuada. Como consequência todos os átomos desta molécula estão localizados num mesmo plano, inclusive as ligações C - H.Alternativa correta, B.Continua após a publicidade..40) Uma indústria fabrica um produto formado pela mistura das quatro aminas de fórmula molecular C3H9N. Com o intuito de separar esses componentes, empregou-se o processo de destilação fracionada, no qual o primeiro componente a ser separado é o de menor ponto de ebulição. Nesse processo, a primeira amina a ser separada é denominada:
FAZER COMENTÁRIO- A) propilamina.
- B) trimetilamina.
- C) etilmetilamina.
- D) isopropilamina.
A alternativa correta é letra B
As quatro aminas de fórmula molecular C3H9N são:
- propilamina
-etilmetilamina
-isopropilamina
-trimetilamina
A primeira amina a ser separada por destilação fracionada é aquela de menor ponto de ebulição. Quando se analisa uma mistura de isômeros, o principal fator que diferencia o ponto de ebulição desses isômeros é o tipo de interação intermolecular. A interação intermolecular mais forte é a ligação de hidrogênio, que é formada entre um átomo muito eletronegativo, no caso o nitrogênio, e o átomo de hidrogênio, que se encontra ligado a um átomo muito eletronegativo, novamente o nitrogênio.
Como a trimetilamina é a única amina que não apresenta átomos de hidrogênio ligados ao nitrogênio, esses átomos não formam ligações de hidrogênio, de forma que essa é a amina de menor ponto de ebulição. - B) tetraédrica e linear;
- B) tetraédrica e plana.
- B) CCl4 tetraédrica polar
