Questões Sobre Ligações Químicas - Química - 1º ano do ensino médio
Questão 41
Nos polímeros supramoleculares, as cadeias poliméricas são formadas por monômeros que se ligam, uns aos outros, apenas por ligações de hidrogênio e não por ligações covalentes como nos polímeros convencionais. Alguns polímeros supramoleculares apresentam a propriedade de, caso sejam cortados em duas partes, a peça original pode ser reconstruída, aproximando e pressionando as duas partes. Nessa operação, as ligações de hidrogênio que haviam sido rompidas voltam a ser formadas, “cicatrizando” o corte.
Um exemplo de monômero, muito utilizado para produzir polímeros supramoleculares, é
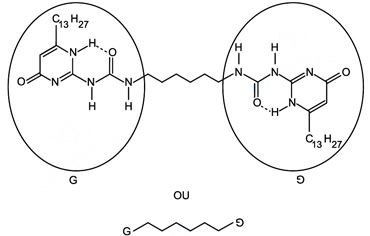
No polimero supramolecular,
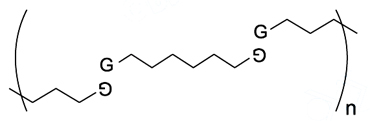
cada grupo G está unido a outro grupo G, adequadamente orientado, por x ligações de hidrogênio, em que x é, no máximo,
- A) 1
- B) 2
- C) 3
- D) 4
FAZER COMENTÁRIO- E) 5
A alternativa correta é letra D
Uma ligação de hidrogênio consiste de um átomo de hidrogênio que se liga especificamente com o N, O ou F. No caso do exercício, as ligações serão entre o H e O ou H e N. Para que estas ligações sejam realizadas, como descreve o enunciado, os grupos G devem estar orientados corretamente. Seguindo a orientação fornecida pelo enunciado, temos 4 ligações de Hidrogênio, 2 entre H--O e 2 entre H--N.Questão 42
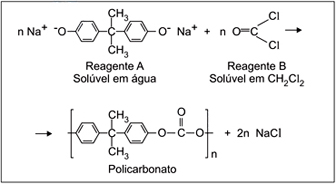 O reagente A só é solúvel em água, enquanto que o reagente B só é solúvel em meio orgânico (CH2Cl2), e os dois solventes são imiscíveis. Para que a reação ocorra, é necessária a utilização de um “catalisador de transferência de fase”. O catalisador deve ser capaz de interagir com o reagente A na fase aquosa, transferindo-o para a fase orgânica. Na fase orgânica, com a formação do polímero, o catalisador é liberado e retorna à fase aquosa, dando continuidade ao processo.
O reagente A só é solúvel em água, enquanto que o reagente B só é solúvel em meio orgânico (CH2Cl2), e os dois solventes são imiscíveis. Para que a reação ocorra, é necessária a utilização de um “catalisador de transferência de fase”. O catalisador deve ser capaz de interagir com o reagente A na fase aquosa, transferindo-o para a fase orgânica. Na fase orgânica, com a formação do polímero, o catalisador é liberado e retorna à fase aquosa, dando continuidade ao processo.
Dentre as substâncias cujas fórmulas são mostradas a seguir, assinale a alternativa que contém a substância que apresenta as características adequadas para atuar como catalisador nesse processo.FAZER COMENTÁRIO- A) NH4+Cl–
- B) [(C16H33)2N(CH3)2]+Cl–
- C) CH3(CH2)4COO–Na+
- D) C16H33–NH2
- E) HCCl3
A alternativa correta é letra B
O catalisador deve ser capaz de se dissolver tanto no meio polar quanto no meio apolar, ou seja, a estrutura do catalisador deve ser dividida em parte polar e apolar. A parte polar irá interagir com o reagente A e a parte apolar com o B. Dentre as alternativa o composto da B é o unico que se encaixa nessa descrição, pois a longa cadeia de carbonos representa a parte apolar e a parte salina (função amina + cloreto) representa a parte polar.43) Observa-se que uma solução aquosa saturada de HCl libera uma substância gasosa. Uma estudante de química procurou representar, por meio de uma figura, os tipos de partículas que predominam nas fases aquosa e gasosa desse sistema – sem representar as partículas de água. A figura com a representação mais adequada seria
FAZER COMENTÁRIO- A)
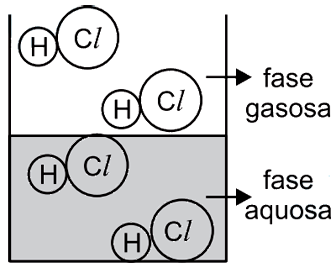
- B)
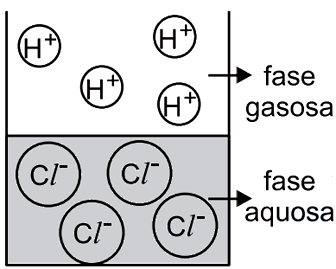
- C)
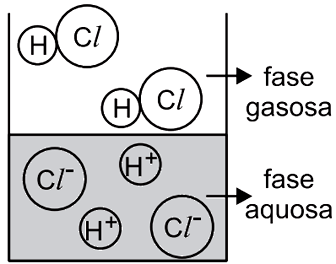
- D)
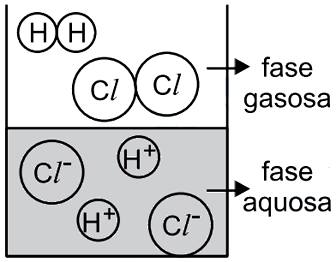
- E)
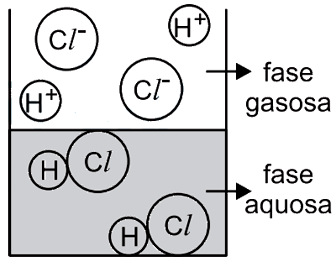
A alternativa correta é letra C
O HCl é uma molécula polar e tem como característica importante o fato de sofre ionização quando encontra-se em solução aquosa. Assim, íons H+ e Cl- são formados na fase líquida. Já na fase gasosa, os átomos estão unidos. Dessa forma, a figura que representa adequadamente o equilíbrio entre fase líquida e gasosa do HCl é a alternativa C.
Portanto, a resposta correta é a alternativa C.Questão 44
Neste ano, o Brasil decidiu suspender, em território nacional, o licenciamento compulsório do anti-retroviral Efavirenz, um medicamento de combate à AIDS. Com esta decisão, o país pode importar um genérico que custa três vezes menos. A maioria dos membros da Organização Mundial da Saúde demonstrou apoio às reivindicações das nações em desenvolvimento, ao aprovar um texto que pede respeito e ajuda aos governos destes países para quebrarem patentes de medicamentos de interesse da saúde pública.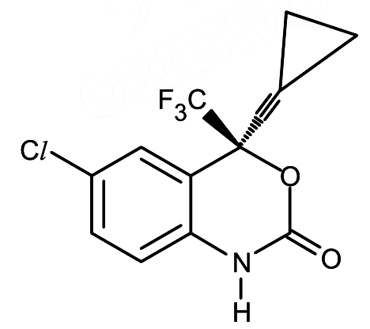 O número de ligações π (pi) entre átomos de carbono na molécula do Efavirenz e o nome da principal força de interação que pode ocorrer entre o grupo NH do medicamento e os fluidos aquosos do nosso organismo são, respectivamente,
O número de ligações π (pi) entre átomos de carbono na molécula do Efavirenz e o nome da principal força de interação que pode ocorrer entre o grupo NH do medicamento e os fluidos aquosos do nosso organismo são, respectivamente,- A) 4 e dipolo-dipolo.
- B) 4 e ligações de hidrogênio.
- C) 5 e dipolo-dipolo.
- D) 5 e ligações de hidrogênio.
FAZER COMENTÁRIO- E) 6 e dipolo-dipolo.
A alternativa correta é letra D
Ligações pi são características dos orbitais px e py de ligações duplas e triplas. Este composto contém 5 ligações pi entre átomos de C e 1 ligação pi entre um átomo de C e O.As ligações de hidrogênio caracterizada pela interação de átomos de N ou O e átomos de H são a principal força de interação entre essas moléculas. As ligações de hidrogênio são a mais forte interação intermolecular.45) Para cumprirem a função de reter grande quantidade de água, as fraldas descartáveis são confeccionadas com um polímero superabsorvente, que contém grande quantidade de íons carboxilato. A capacidade de retenção deve-se em parte às forças intermoleculares entre os grupos carboxilatos e a água. A interação mais forte que ocorre entre essas moléculas é do tipo:
- A) dispersão de London-dipolo permanente.
- B) ligações de carbono.
- C) ligações iônicas.
- D) íon-dipolo permanente.
FAZER COMENTÁRIO- E) dipolo permanente-dipolo permanente.
A alternativa correta é letra D
Sabendo que os íons carbolatos são COO-, pode-se dizer que as ligações entre esses íons e a água são do tipo íon-dipolo permanente. Já que se trata da interação entre o íon carboxilato e a água, que é uma substância polar.Portanto, a resposta correta é alternativa D.46) Considere os seguintes compostos isoméricos:
FAZER COMENTÁRIO- A) a uma mesma pressão, o éter dietílico sólido funde a uma temperatura mais alta do que o butanol sólido.
- B) a uma mesma temperatura, a viscosidade do éter dietílico líquido é maior do que a do butanol líquido.
- C) a uma mesma pressão, o butanol líquido entra em ebulição a uma temperatura mais alta do que o éter dietílico líquido.
- D) a uma mesma pressão, massas iguais de butanol e éter dietílico liberam, na combustão, a mesma quantidade de calor.
- E) nas mesmas condições, o processo de evaporação do butanol líquido é mais rápido do que o do éter dietílico líquido.
A alternativa correta é letra C
O butanol apresenta ligações de hidrogênio entre as moléculas, pois apresenta uma ligação entre O–H. Já o éter dietílico não apresenta ligações de hidrogênio, e os átomos estão ligados apenas por Forças de Van der Waals. As ligações de hidrogênio aumentam as interações intermoleculares e, por isso, fazem com que o butanol apresente maior ponto de ebulição e de fusão, além da maior viscosidade do que o éter dietílico. Quanto ao calor de combustão, a quantidade de calor liberada de duas substâncias diferentes serão diferentes. Portanto, a resposta correta é a alternativa C.47) A geometria molecular e a polaridade das moléculas são conceitos importantes para predizer o tipo de força de interação entre elas. Dentre os compostos moleculares nitrogênio, dióxido de enxofre, amônia, sulfeto de hidrogênio e água, aqueles que apresentam o menor e o maior ponto de ebulição são, respectivamente,
- A) SO2 e H2S.
- B) N2 e H2O.
- C) NH3 e H2O.
FAZER COMENTÁRIO- D) N2 e H2S.
- E) SO2 e NH3.
A alternativa correta é letra B
O ponto de ebulição está relacionado com a quebra de ligações. Ligações polares apresentam maior ponto de ebulição do que as apolares, pelo fato destas necessitarem de maior energia para serem rompidas. Dentre as polares, a ligação que necessita de maior energia para ser rompida é a ligação de hidrogênio. Analisando as moléculas temos:N2 : apolar, ligação do tipo dipolo instantâneo - dipolo induzido.SO2 : polar, ligação do tipo dipolo-dipolo.H2S : polar ligação do tipo dipolo-dipolo.NH3 : polar ligação de hidrogênio.H2O : polar ligação de hidrogênio.Temos, portanto, que a ligação mais fraca é a apolar existente entre os átomos de nitrogênio no N2. A ligação mais forte é a ligação de hidrogênio, existente nas moléculas de amônia e água. Porém, a água faz quatro ligações de hidrogênio por molécula, enquanto a amônia faz apenas duas. Dessa forma, pela água possuir maior número de ligações de hidrogênio ela requer mais energia para romper essas ligações e, portanto, possui maior ponto de ebulição que os outros compostos.48) A um frasco graduado contendo 50 mL de álcool etílico foram adicionados 50 mL de água, sendo o frasco imediatamente lacrado para evitar perdas por evaporação. O volume da mistura foi determinado, verificando-se que era menor do que 100 mL.
FAZER COMENTÁRIO- A) os volumes das moléculas de ambas as substâncias diminuíram após a mistura.
- B) os volumes de todos os átomos de ambas as substâncias diminuíram após a mistura.
- C) a distância média entre moléculas vizinhas diminuiu após a mistura.
- D) ocorreu reação química entre a água e o álcool.
- E) nas condições descritas, mesmo que fossem mistu rados 50 mL de água a outros 50 mL de água, o volume final seria inferior a 100 mL.
A alternativa correta é letra C
Para a resolução da questão, é necessário que se tenha em mente que a adição de água à um frasco contendo álcool etílico não produz uma reação química. Como o enunciado garante que a diminuição do volume no frasco não foi causada por evaporação, temos:
c) Correta. A diminuição do volume é causada pela diminuição da distância entre as móleculas de água e álcool. Esta diminuição é fruto das pontes de hidrogênio formadas entre as moléculas de água e álcool, que são mais fortes do que as interações entre, apenas, as moléculas de álcool.Questão 49
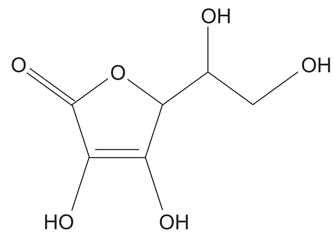 Considerando suas atrações interatômicas e intermoleculares, esse caráter hidrossolúvel é justificado pelo fato de a vitamina C apresentar uma estrutura composta de:FAZER COMENTÁRIO
Considerando suas atrações interatômicas e intermoleculares, esse caráter hidrossolúvel é justificado pelo fato de a vitamina C apresentar uma estrutura composta de:FAZER COMENTÁRIO- A) heteroátomos.
- B) íons aglomerados.
- C) dipolos permanentes.
- D) carbonos assimétricos.
A alternativa correta é letra C
Moléculas polares possuem uma força dipolo elétrico permanente (ou, simplesmente, dipolo permanente) de tal forma que a extremidade negativa do dipolo de uma molécula se aproxime da extremidade positiva do dipolo de outra.
A diferença de eletronegatividade ao longo da molécula - leia-se, polaridade - promove a interação entre moléculas que apresentem esta mesma característica. O caráter polar ou apolar de uma substância define se esta será mais ou menos solúvel num determinado solvente. Desta forma, moléculas polares tendem a se dissolver em líquidos polares e moléculas apolares em líquidos apolares.
Assim, o caráter hidrossolúvel da vitamina C é explicável pela característica polar desta molécula (devido principalmente à presença de quatro grupos OH-), sendo solúvel em água (substância polar).
Portanto, a resposta correta é a alternativa C.Continua após a publicidade..Questão 50
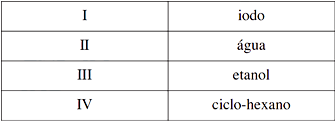 Forças intermoleculares do tipo ligações de hidrogênio podem ocorrer na interação das substâncias
Forças intermoleculares do tipo ligações de hidrogênio podem ocorrer na interação das substâncias- A) I e II.
- B) I e III.
- C) II e III.
- D) II e IV.
FAZER COMENTÁRIO- E) III e IV.
« Anterior 1 … 3 4 5 6 7 8 Próximo »A alternativa correta é letra C
Forças intermoleculares do tipo ligações de hidrogênio são identificadas quando o hidrogênio interage com os compostos flúor, oxigênio ou nitrogênio. Logo, avaliando a fórmula molecular de cada substância:Iodo (I2); Água (H2O); Etanol (CH3CH2OH) e Ciclo-hexano (C6H12), as substâncias que interagem por ligações de hidrogênio são: água e etanol. Alternativa C. - B) I e III.
- B) ligações de carbono.
- B) 4 e ligações de hidrogênio.
- B) 2
