Questões Sobre Propriedades Coligativas - Química - 1º ano do ensino médio
1) Considere as soluções aquosas abaixo a uma pressão de 1,0 atm
- A) as soluções A e C apresentam o mesmo ponto de congelamento.
- B) as três soluções apresentam ponto de ebulição abaixo de 100º C.
- C) a solução B apresenta o maior ponto de ebulição.
FAZER COMENTÁRIO- D) a solução C é a que apresenta menor pressão de vapor.
A alternativa correta é letra A
O ponto de congelamento de uma solução guarda relação com a quantidade de partículas presentes na solução. Na solução A temos 0,6 mol/L de (C2H12O6) que não se dissocia em água. Na solução C temos 0,2 mol/L de MgCl2 que se dissocia formando
0,2 MgCl2 ⇒ 0,2 Mg + 0,2.(2Cl-) = 0,6 mol/L de partículas. Por isso o ponto de congelamento das soluções A e C são iguais. Alternativa correta: A2) Considerando a água pura, uma solução aquosa de glicose de concentração igual a 3,0 mol L–1 e uma solução aquosa de CaCl2 de concentração igual a 1,0 mol L–1, assinale a alternativa que apresenta a ordem correta para as temperaturas de ebulição (Te) desses líquidos.
- A) Te água > Te da solução contendo glicose > Te da solução contendo CaCl2
- B) Te água < Te da solução contendo glicose < Te da solução contendo CaCl2
- C) Te água = Te da solução contendo glicose = Te da solução contendo CaCl2
- D) Te água < Te da solução contendo glicose = Te da solução contendo CaCl2
FAZER COMENTÁRIO- E) Te água > Te da solução contendo glicose = Te da solução contendo CaCl2
A alternativa correta é letra D
Com as condições das soluções de glicose e de CaCl2, é necessário lembrar das propriedades coligativas das soluções, em específico, a ebulioscopia. Sabendo que a glicose e o CaCl2 estão dissolvidos, já se pode concluir que a temperatura de ebulição das duas soluções são maiores que a da água pura. Comparando as duas soluções, a partir das respectivas concentrações, como possuem a mesma quantidade molar de partículas dissociadas (3 mols de glicose, e 1 mol de Ca2+ + 2 mols de Cl–), ambas as soluções terão pontos de ebulição iguais. Portanto, a resposta correta é a alternativa D.3) Descoberta nova técnica para
- A) filtração.
- B) destilação.
- C) osmose.
- D) peneiração.
FAZER COMENTÁRIO- E) desidratação.
A alternativa correta é letra C
A osmose consiste na passagem do solvente por uma membrana que impede a passagem do soluto. No caso, a água passa pela membrana e o sal fica retido.4) A crioscopia é uma técnica utilizada para determinar a massa molar de um soluto através da diminuição da temperatura de solidificação de um líquido, provocada pela adição de um soluto não volátil. Por exemplo, a temperatura de solidificação da água pura é 0°C (pressão de 1 atm), mas ao se resfriar uma solução aquosa 10% de cloreto de sódio, a solidificação ocorrerá a –2°C. A adição de soluto não volátil a um líquido provoca
- A) nenhuma alteração na pressão de vapor desse líquido.
- B) o aumento da pressão de vapor desse líquido.
- C) o aumento da temperatura de solidificação desse líquido.
- D) a diminuição da temperatura de ebulição desse líquido.
FAZER COMENTÁRIO- E) a diminuição da pressão de vapor desse líquido.
A alternativa correta é letra E
A adição de um soluto não volátil a um liquido provoca a DIMINUIÇÃO da pressão de vapor desse líquido, o que leva a um AUMENTO da temperatura de ebulição desse líquido e a DIMINUIÇÃO da temperatura de solidificação deste líquido.5) O etilenoglicol é uma substância muito solúvel em água, largamente utilizado como aditivo em radiadores de motores de automóveis, tanto em países frios como em países quentes. Considerando a função principal de um radiador, pode- se inferir corretamente que
FAZER COMENTÁRIO- A) a solidificação de uma solução aquosa de etilenoglicol deve começar a uma temperatura mais elevada que a da água pura e sua ebulição, a uma temperatura mais baixa que a da água pura.
- B) a solidificação de uma solução aquosa de etilenoglicol deve começar a uma temperatura mais baixa que a da água pura e sua ebulição, a uma temperatura mais elevada que a da água pura.
- C) tanto a solidificação de uma solução aquosa de etilenoglicol quanto a sua ebulição devem começar em temperaturas mais baixas que as da água pura.
- D) tanto a solidificação de uma solução aquosa de etilenoglicol quanto a sua ebulição devem começar em temperaturas mais altas que as da água pura.
A alternativa correta é letra B
A adição do etilenoglicol visa alterar as propriedades coligativas naturais da água (ponto de fusão e ponto de ebulição). O etilenoglicol na água eleva o ponto de ebulição da mesma;ela entrará em ebulição acima dos 100°C e abaixará o ponto de solidificação da água; a ela se solidificará abaixo de 0°C.
Letra B.Questão 6
As curvas de pressão de vapor, em função da temperatura, para um solvente puro, uma solução concentrada e uma solução diluída são apresentadas na figura abaixo. Considerando que as soluções foram preparadas com o mesmo soluto não volátil, pode-se afirmar que as curvas do solvente puro, da solução concentrada e da solução diluída são, respectivamente,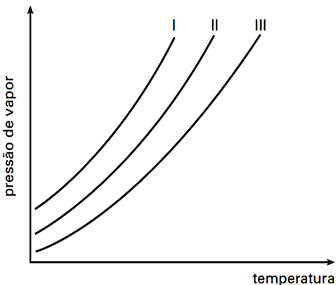
- A) I, II e III.
- B) I, III e II.
- C) II, III e I.
- D) II, I e III.
FAZER COMENTÁRIO- E) III, II e I.
A alternativa correta é letra B
Com adição do soluto puro não volátil, há uma diminuição na pressão de vapor da solução. Assim, analisando as curvas, dada um temperatura, sabe-se que a curva com menor pressão equivale à solução mais concentrada , a curva do meio é a solução diluída e a com maiores pressões é a do solvente puro.Portanto, a resposta correta é a alternativa B.7) Estudos comprovam que o Mar Morto vem perdendo água há milhares de anos e que esse processo pode ser acelerado com o aquecimento global, podendo, inclusive, secar em algumas décadas. Com relação a esse processo de perda de água, foram feitas as seguintes afirmações: I. a concentração de NaCl irá diminuir na mesma proporção da perda de água; II. a condutividade da água aumentará gradativamente ao longo do processo; III. a densidade da água, que hoje é bastante alta, irá diminuir com o tempo; IV. o ponto de ebulição da água irá aumentar gradativamente.Está correto o contido apenas em
FAZER COMENTÁRIO- A) I.
- B) III.
- C) I e III.
- D) II e III.
- E) II e IV.
A alternativa correta é letra E
Afirmação I - FALSA: a concentração de cloreto de sódio irá aumentar devido à diminuição do volume da água;Afirmação II - CORRETA: devido ao aumento da concentração de sal na água do mar, teremos também o aumento da condutividade elétrica desta água. Lembrando que a condução de corrente elétrica (i) depende da quantidade (concentração) de íons livres em solução;Afirmação III - FALSA: a densidade da água do mar morto irá aumentar ainda mais com a evaporação da água;Afirmação IV - CORRETA: teremos aumento da temperatura de ebulição da água devido ao aumento da concentração de sal (propriedade coligativa: aumento da temperatura de ebulição depende da quantidade de soluto dissolvida).Questão 8
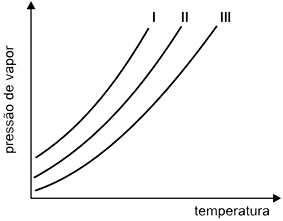 Considerando que as soluções foram preparadas com o mesmo soluto não volátil, pode-se afirmar que as curvas do solvente puro, da solução concentrada e da solução diluída são, respectivamente,
Considerando que as soluções foram preparadas com o mesmo soluto não volátil, pode-se afirmar que as curvas do solvente puro, da solução concentrada e da solução diluída são, respectivamente,- A) I, II e III
- B) I, III e II
- C) II, III e I
- D) II, I e III
FAZER COMENTÁRIO- E) III, II e I
A alternativa correta é letra B
Em uma solução (mistura homogênea de dois compostos), é definido um estado de equilíbrio, tendo propriedades e características próprias. Tais propriedades são chamadas de propriedades coligativas e dependem do número de partículas em solução. Quando é adicionado um soluto na solução inicial, há a mudança neste estado de equilíbrio, alterando as propriedades, já que a quantidade de partículas aumentou. Uma propriedade alterada é a tonoscopia (abaixamento da pressão de vapor), intimamente ligada com a ebulioscopia (aumento da temperatura de fusão). Com isso, pode-se comparar os diagramas, sendo que quanto maior a pressão de vapor, mais volátil é a solução e mais diluída (ou pura) ela é. Neste caso, a curva I trata-se do solvente puro, II é do soluto diluído e III é do solvente concentrado. Portanto, a resposta correta é a alternativa B.9) Nos invernos rigorosos, é costume europeu aspergir cloreto de sódio ou cloreto de cálcio em ruas e estradas cobertas de gelo, bem como, adicionar etilenoglicol à água do radiador dos automóveis. Com esses procedimentos, qual alteração se deseja provocar na água?
- A) Diminuição da temperatura de ebulição.
- B) Aumento da condutibilidade elétrica.
- C) Diminuição da densidade.
- D) Aumento da pressão de vapor.
FAZER COMENTÁRIO- E) Diminuição da temperatura de congelamento.
A alternativa correta é letra E
O efeito causado pela adição de cloreto de sódio ou cloreto de cálcio em ruas e estradas cobertas de gelo ou de etilenoglicol à água do radiador dos automóveis é explicado pela propriedade coligativa denominada crioscopia.A crioscopia pode ser definida como a diminuição do ponto de congelamento de um líquido pela adição de um soluto não - volátil.É isto o que ocorre ao se realizar tais procedimentos. Ao se adicionar solutos não - voláteis, como cloreto de sódio ou cálcio e etilenoglicol, a formação de novas interações intermoleculares dificulta a organização da água para a formação do gelo. Ou seja, a água irá congelar a uma temperatura inferior a 0ºC.Tal propriedade é útil pois o gelo depositado nas ruas pode causar acidentes e danificar automóveis, enquanto que a água líquida escoa facilmente não causando grandes trasnstornos.Alternativa correta, E.Continua após a publicidade..10) Os nossos ancestrais descobriram que a carne, quando era tratada com cloreto de sódio, ficava preservada do ataque bacteriano. Esse processo primitivo de conservação é usado até hoje e a conservação é por
- A) óxido-redução.
- B) anti-catálise.
- C) ação bactericida.
- D) osmose.
FAZER COMENTÁRIO- E) esterilização.
1 2 Próximo »A alternativa correta é letra D
O processo de salgamento das carnes utilizando cloreto de sódio (NaCl) é eficaz por gerar um grande excesso do sal no ambiente, promovendo a desidratação dos agentes bacterianos. A desidratação ocorre já que haverá a saída de água do interior das células das bactérias para o exterior, tentando dimunuir o gradiente de concentração do sal na interface interior/exterior celular.Esse fenômeno de passagem de água (solvente) é denominado osmose.Portanto, a resposta correta é a alternativa D. - B) anti-catálise.
- B) Aumento da condutibilidade elétrica.
- B) I, III e II
- B) I, III e II.
- B) o aumento da pressão de vapor desse líquido.
- B) destilação.
- B) Te água < Te da solução contendo glicose < Te da solução contendo CaCl2
- B) as três soluções apresentam ponto de ebulição abaixo de 100º C.
