Questões Sobre Propriedades da Matéria - Química - 1º ano do ensino médio
21) A água líquida e o gelo apresentam densidades volumétricas diferentes. Ao colocar um recipiente com água num congelador, após certo tempo, ela se solidificará, sua massa permanecerá constante e seu volume se alterará. Quando colocamos 100 g de água líquida num congelador, ao transformar-se em gelo, seu volume
- A) aumentará para, aproximadamente, 192 cm3.
- B) aumentará para, aproximadamente, 145 cm3.
- C) aumentará para, aproximadamente, 109 cm3.
- D) diminuirá para, aproximadamente, 96 cm3.
- E) diminuirá para, aproximadamente, 92 cm3.
A alternativa correta é letra C
Densidade = m/v
Vgelo = m/ densidadeg
Vgelo= 100/0,92
=109 cm3
Vgelo = m/ densidadeg
Vgelo= 100/0,92
=109 cm3
22) Adiciona-se determinada quantidade de soluto sólido e não-volátil em 500 mL de água. Uma das alterações provocadas no solvente é:
- A) aumento da pressão de vapor
- B) diminuição do volume
- C) aumento da temperatura de congelação
- D) diminuição da condutividade elétrica
FAZER COMENTÁRIO- E) aumento da temperatura de ebulição
A alternativa correta é letra E
Ao adicionar um soluto sólido em água, há o aumento na temperatura de ebulição em relação a agua pura e a solução formada (fenômeno chamado de ebulioscopia) devido principalmente às ligações existentes entre as moléculas de água e as do soluto não volátil.Portanto, a resposta correta é a alternativa E.23) O uso de panela de pressão diminui consideravelmente o tempo de cozimento dos alimentos. Isso se deve:
FAZER COMENTÁRIO- A) a uma distribuição mais uniforme do calor, sendo a temperatura de ebulição da água 100ºC ao nível do mar, mesmo dentro da panela.
- B) à água estar na forma de vapor dentro da panela, sem que haja necessariamente um aumento de temperatura.
- C) ao aumento do ponto de ebulição da água pelo aumento da pressão interna da panela.
- D) ao fato de que os alimentos, sob pressão, cozinharem mais facilmente, não sendo assim um efeito do aumento da temperatura.
- E) à diminuição do ponto de fusão dos alimentos pelo aumento da pressão.
A alternativa correta é letra C
A diminuição do tempo de cozimento de alimentos quando se utiliza a panela de pressão é decorrente do aumento do ponto de ebulição da água pelo aumento da pressão interna da panela.Ao nível do mar, a água pura ferve a 100ºC. Ao atingir tal temperatura, a água líquida passa para o estado de vapor, não havendo aumento da temperatura durante este processo.Na panela de pressão, ao se atingir essa temperatura, algumas moléculas de água começam a passar para o estado gasoso, aumentando a pressão no interior da panela. Esse aumento da pressão interna do sistema dificulta a passagem de outras moléculas de água para o estado gasoso. O resultado é um aumento da temperatura de ebulição da água. Dessa forma, a uma temperatura maior, os alimentos são cozidos mais rapidamente.Alternativa correta, C.24) A fenilcetonúria é uma doença hereditária em que uma pessoa afetada não consegue metabolizar a fenilalanina e, por isso acumula a fenilalanina no sangue, com consequências graves para o organismo. Uma dieta alimentar para um fenilcetonúrico deve ter uma severa vigilância quanto ao consumo de:
- A) Proteínas
- B) esteróides
- C) polissacarídeos
- D) lipídios
FAZER COMENTÁRIO- E) monossacarídeos
A alternativa correta é letra A
O sufixo -alanina indica que a substância fenilalanina pertence ao grupo dos aminoácidos, que compõe as proteínas.Portanto, a resposta correta é a alternativa A.Questão 25
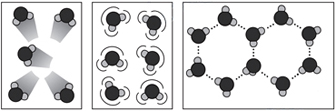 1 2 3
1 2 3
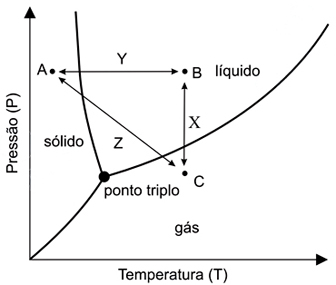
Tomando por base os pontos A, B e C, os processos X, Y e Z e as figuras 1, 2 e 3, pode-se afirmar queFAZER COMENTÁRIO- A) Z representa mudança de pressão e temperatura, e a figura 3 corresponde ao ponto A.
- B) X representa mudança de pressão e temperatura, e a figura 3 corresponde ao ponto A.
- C) Y representa apenas mudança de temperatura, e a figura 2 corresponde ao ponto C.
- D) X representa apenas mudança de temperatura, e a figura 2 corresponde ao ponto B.
- E) Z representa mudança de pressão e temperatura, e a figura 1 corresponde ao ponto B.
A alternativa correta é letra A
O processo X representa a diminuição de pressão à temperatura constante. O processo Y é o aumento de temperatura à pressão constante e o processo Z é o aumento da temperatura com diminuição da pressão.A figura 3 mostra que as moléculas estão próximas e presas umas as outras, caracterizando o estado sólido (A), a figura 2 mostra moléculas com ligações intermoleculares mais fracas, representando o estado sólido (B) e 1 representa moléculas distante uma das outras que praticamente não interagem entre si, ou seja o estado gasoso (C).Desse modo, a alternativa correta é A.26) As espécies químicas oxigênio e ozônio são:
- A) isótopos
- B) alótropos
- C) isóbaros
- D) isoelétrônicos
FAZER COMENTÁRIO- E) isótonos
A alternativa correta é letra B
O oxigênio gasoso apresenta a fórmula O2 e o ozônio é O3. Assim, ambos são compostos pelo mesmo elemento, o oxigênio atômico. Essa característica é chamada de alotropia, assim, o oxigênio gasoso e o ozônio são alótropos.Portanto, a resposta correta é a alternativa B.Questão 27
Disponível em https://www.boredpanda.com/.Em Xangai, uma loja especializada em café oferece uma opção diferente para adoçar a bebida. A chamada sweet little rain consiste em uma xícara de café sobre a qual é pendurado um algodão-doce, material rico em sacarose, o que passa a impressão de existir uma nuvem pairando sobre o café, conforme ilustrado na imagem.
O café quente é então adicionado na xícara e, passado um tempo, gotículas começam a pingar sobre a bebida,simulando uma chuva doce e reconfortante. A adição de café quente inicia o processo descrito, pois FAZER COMENTÁRIO
FAZER COMENTÁRIO- A) a temperatura do café é suficiente para liquefazer a sacarose do algodão-doce, fazendo com que este goteje na forma de sacarose líquida.
- B) o vapor de água que sai do café quente irá condensar na superfície do algodão-doce, gotejando na forma de água pura.
- C) a sacarose que evapora do café quente condensa na superfície do algodão-doce e goteja na forma de uma solução de sacarose em água.
- D) o vapor de água encontra o algodão-doce e solubiliza a sacarose, que goteja na forma de uma solução de sacarose em água.
- E) o vapor de água encontra o algodão-doce e vaporiza a sacarose, que goteja na forma de uma solução de sacarose em água.
A alternativa correta é letra D
A figura mostra uma xícara com café quente. Logo acima, uma porção de algodão doce preso a um suporte.
Como o café está quente, a água vaporiza-se e, ao encontrar a superfície fria do algodão doce, condensa-se,solubilizando a sacarose, que, dissolvida em água,goteja sobre o café.
Resposta pesquisada na internet: Fonte Objetivo.28) Balões de festa de aniversario deixados sob sol forte podem estourar porque o volume do gás contido em seu interior aumenta com o aumento da temperatura e acaba rompendo a superfície do balão depois que esta se estica até um tamanho máximo. Isso ocorre porque o aumento da temperatura eleva a energia das partículas que, com maior movimento, passam a ocupar um volume maior, no caso das moléculas dos gases contidos no balão. A variação da energia das partículas com a variação da temperatura também causa a compactação, que reduz o volume de substâncias ao se solidificarem com o abaixamento da temperatura, quando a energia das partículas diminui. Com a água é diferente: ao passar do estado líquido para o estado solido, com o abaixamento da temperatura ocorre aumento de volume, por isso não se deve colocar no congelador garrafa cheia com água e lacrada. Assinale a alternativa que explica corretamente o comportamento da água ao passar do estado líquido para estado sólido.
- A) No estado sólido, as moléculas de água formam pontes de hidrogênio com a superfície interna da garrafa, que se rompe devido ao efeito da pressão adicional exercida.
- B) Na água líquida há sais minerais dissolvidos, que se cristalizam quando o gelo e formado e ocupam maior espaço. Assim, o volume do gelo é maior que o volume da água líquida.
- C) Na formação do gelo, as moléculas de água assumem posições definidas numa estrutura organizada, mantida por ligações de hidrogênio. As moléculas nesta estrutura ocupam maior espaço do que no estado liquido, onde se organizam de maneira diferente.
- D) No estado sólido, as moléculas de água formam estrutura cristalina tridimensional, com átomos unidos por ligação iônica em posições fixas, que ocupam maior espaço que a geometria planar das moléculas no estado líquido.
FAZER COMENTÁRIO- E) A auto-ionização da água, responsável pelas espécies iônicas que são unidas por ligações iônicas no estado liquido, e desfavorecida com o abaixamento da temperatura. Assim, a força de ligação das moléculas de água no gelo é mais fraca e a distância entre elas aumenta, aumentando o volume ocupado.
A alternativa correta é letra C
Esse fenômeno ocorre devido à maior organização das moléculas de água no seu estado sólido, sendo que esta organização ocupa um espaço maior devido à disposição das moléculas ligadas por ligações de hidrogênio, fazendo com que o volume aumente. Já no estado líquido, essa organização é rompida parcialmente, fazendo com que as moléculas se compactem, ocupando espaços vazios deixados pela disposição no estado sólido.Portanto, a resposta correta é a alternativa C.29) Duas amostras de naftalina, uma de 20,0g (amostra A )e outra de 40,0g (amostra B ), foram colocadas em tubos de ensaio separados, para serem submetidas à fusão. Ambas as amostras foram aquecidas por uma mesma fonte de calor. No decorrer do aquecimento de cada uma delas, as temperaturas foram anotadas de 30 em 30 segundos.
- A) I.
- B) II.
- C) III.
- D) II e III.
FAZER COMENTÁRIO- E) III e IV.
A alternativa correta é letra E
Por se tratar da mesma substância, o ponto de fusão de cada amostra é igual. E como a fonte de calor é a mesma, ou seja, a quantidade de calor fornecida é igual, terá que a amostra A, por possuir uma menor massa, atingirá a fusão primeiramente. Assim, somente os itens III e IV estão corretos.Portanto, a resposta correta é a alternativa E.Continua após a publicidade..Questão 30
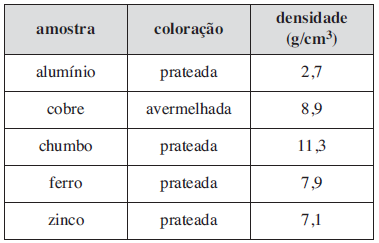 Após constatar que os grupos identificaram corretamente os metais, o professor fez as seguintes observações:
Após constatar que os grupos identificaram corretamente os metais, o professor fez as seguintes observações:
• O metal do grupo 1 tinha coloração avermelhada.
• O metal do grupo 2 tinha menor densidade dentre os metais do experimento.
• O metal do grupo 3 tinha massa = 39,5 g e a proveta utilizada por esse grupo tinha volume de 25 mL com água e de 30 mL com água mais amostra.
• O metal do grupo 4 tinha maior densidade que o do grupo 5.
A amostra recebida pelo grupo 5 foi a do metalFAZER COMENTÁRIO- A) cobre.
- B) zinco.
- C) chumbo.
- D) ferro.
- E) alumínio.
A alternativa correta é letra B
Lembrando que 1cm3 = 1 mL e seguindo a ordem das informações dadas pelos grupos e analisando a tabela mostrada na questão:
Grupo 1: Cobre
Grupo 2: Alumínio
Grupo3: Ferro; onde sua densidade é calculada pela divisão entre a massa (39,5g) pela variação de volume (30 mL- 25 mL = 5 mL) , totalizando uma densidade de 7,9 g/mL.
Assim restaram apenas dois compostos a serem analisados: Chumbo e Zinco.
Grupo 4: Chumbo, pois tem maior densidade dentre os dois compostos restantes (11,9 g /mL)
Grupo 5: Zinco, tem densidade igual a 7,1 g/mL , onde esta é menor do que a do chumbo.
Letra B. - B) II.
- B) Na água líquida há sais minerais dissolvidos, que se cristalizam quando o gelo e formado e ocupam maior espaço. Assim, o volume do gelo é maior que o volume da água líquida.
- B) alótropos
- B) esteróides
- B) diminuição do volume
