Continua após a publicidade..
Adicionam-se 650 mL de solução de sulfato de alumínio de concentração 0,01mol.L-1 a 100 mL de solução de hidróxido de cálcio de concentração 0,03mol.L-1. A equação não balanceada da reação é a seguinte:
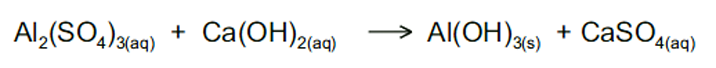
Assinale a alternativa que apresenta a concentração de sulfato de cálcio, em mol.L-1, presente na solução final.
- A) 0,002.
- B) 0,004.
- C) 0,020.
- D) 0,030.
- E) 0,040.
Resposta:
A alternativa correta é letra B
Esta é uma questão de mistura de soluções com ocorrência de reação química. Primeiramente, deve-se balancear a equação que representa a reação ocorrida:
A partir dos volumes e concentrações das soluções adicionadas, podemos determinar o número de mols de cada reagente que foi adicionado à solução, utilizando:.
Para o sulfato de alumínio, temos:
E para o hidróxido de cálcio, temos:
Sendo o hidróxido de cálcio o reagente em menor quantidade (em número de mols), é o reagente limitante, enquanto que, o sulfato de alumínio é o reagente em excesso. Assim, pela estequiometria da reação, a quantidade de hidróxido de cálcio que reage é a mesma de sulfato de cálcio (CaSO4) que é produzido. Ou seja, ao final da reação, serão produzidos 0,003 mols de CaSO4. A fim de se determinar a concentração final, basta utilizar a seguinte relação:
Portanto, a alternativa correta é B.

Deixe um comentário