Continua após a publicidade..
Água e etanol misturam-se completamente, em quaisquer proporções. Observa-se que o volume final da mistura é menor do que a soma dos volumes de etanol e de água empregados para prepará-la. O gráfico a seguir mostra como a densidade varia em função da porcentagem de etanol (em volume) empregado para preparar a mistura (densidades medidas a 20°C).
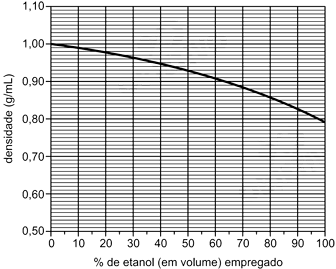
Se 50 mL de etanol forem misturados a 50 mL de água, a 20°C, o volume da mistura resultante, a essa mesma temperatura, será de, aproximadamente,
Se 50 mL de etanol forem misturados a 50 mL de água, a 20°C, o volume da mistura resultante, a essa mesma temperatura, será de, aproximadamente,
- A) 76 mL.
- B) 79 mL.
- C) 86 mL.
- D) 89 mL.
- E) 96 mL.
Resposta:
A alternativa correta é letra E
A partir do gráfico apresentado, observamos que a densidade de solução de água pura é de 1,00 g/mL e a densidade de álcool puro é 0,79 g/mL. Dessa forma, em uma mistura de 50 mL de água e 50 mL de etanol, a massa de cada substancia será:
Etanol:
Água:
A massa da mistura será:
De acordo com o gráfico, a densidade para a mistura com 50% de etanol é 0,93 g/mL. Logo:
A resposta correta é letra E, aproximadamente 96 mL.
Etanol:
Água:
A massa da mistura será:
De acordo com o gráfico, a densidade para a mistura com 50% de etanol é 0,93 g/mL. Logo:
A resposta correta é letra E, aproximadamente 96 mL.

Deixe um comentário