Continua após a publicidade..
Em água, o aminoácido alanina pode ser protonado, formando um cátion que será designado por ala+; pode ceder próton, formando um ânion designado por ala–. Dessa forma, os seguintes equilíbrios podem ser escritos: ala + H3O+ ⇔ H2O + ala+ ala + H2O ⇔ H3O+ + ala– A concentração relativa dessas espécies depende do pH da solução, como mostrado no gráfico.
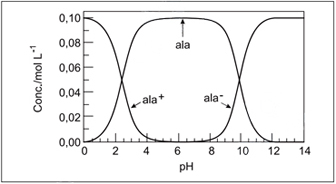
Quando [ala] = 0,08 mol L–1, [ala+] = 0,02 mol L–1 e [ala–] for desprezível, a concentração hidrogeniônica na solução, em mol L–1, será aproximadamente igual a
- A) 10–11
- B) 10–9
- C) 10–6
- D) 10–3
- E) 10–1
Resposta:
A alternativa correta é letra D
Observando no gráfico, para as concentrações de [ala] = 0,08mol.L-1 e [ala+] = 0,02 mol.L-1, o pH é igual a 3.
Aplicando o valor do pH na equação pH = -log [H+], podemos encontrar a concentração hidrogeniônica da solução:
pH = -log [H+]
3 = -log [H+]
[H+] = 10-3 mol.L-1.

Deixe um comentário