Questões Sobre Soluções - Química - 1º ano do ensino médio
11) Um aluno da Fatec foi ao laboratório de Química para realizar esse experimento. Lá ele encontrou apenas uma solução aquosa de NaOH de concentração 0,5 mol/L. Para realizar a experiência na concentração descrita no texto, a partir da solução que ele encontrou, deverá realizar uma
- A) diluição com água.
- B) evaporação de água.
- C) dissolução de NaOH sólido.
- D) titulação de precipitação de NaOH.
- E) mistura com uma solução de NaCl.
A alternativa correta é letra A
Percebe-se que a concentração da solução encontrada é maior do que a requerida na experiência. Sendo assim, através de uma diluição com água chega-se a concentração desejada, pois a adição de mais solvente fará com que a concentração diminua.
Pode-se haver alguma confusão com os termos diluição e dissolução, visto que as duas alternativas estão presentes. Entretanto, diluir está relacionado a adicionar mais solvente, enquanto que dissolução envolve a adição de soluto em solvente com o intuito de misturar homogeneamente uma substância, ou seja, decompor. O solvente é dissolvido, mas para se diluir acrescenta-se uma quantidade de solvente puro.
Evaporar água significa remover solvente, precipitação é a formação de uma substância insolúvel e adicionar NaCl formaria uma solução com solutos diferentes com o mesmo cátion em comum.
Pode-se haver alguma confusão com os termos diluição e dissolução, visto que as duas alternativas estão presentes. Entretanto, diluir está relacionado a adicionar mais solvente, enquanto que dissolução envolve a adição de soluto em solvente com o intuito de misturar homogeneamente uma substância, ou seja, decompor. O solvente é dissolvido, mas para se diluir acrescenta-se uma quantidade de solvente puro.
Evaporar água significa remover solvente, precipitação é a formação de uma substância insolúvel e adicionar NaCl formaria uma solução com solutos diferentes com o mesmo cátion em comum.
12) Para se obter etanol anidro (100%puro), trata-se o álcool etílico ou álcool comum (96º GL) com cal virgem (CaO). Esta reage com a água presente no álcool, formando Ca(OH)2. A substância Ca(OH)2, que é insolúvel, pode então ser separada do etanol por filtração.
- A) 28% de água.
- B) 28% de álcool.
- C) 72% de álcool.
- D) 72% de álcool e água.
FAZER COMENTÁRIO- E) 28% de álcool e água.
A alternativa correta é letra D
De acordo com as informações do texto, pode-se inferir que, numa bebida cujo teor alcoólico é de 28%, há um total de 72% de álcool e água.O teor alcoólico, em volume, é definido como o volume medido (em dm3) de álcool etílico (anidro) em 100 dm3 de bebida. Ou seja, numa bebida destilada cujo teor alcoólico é de 28%, isto significa que há 28% de álcool etílico anidro. O restante da solução (neste caso a solução é a bebida), equivalente a 72%, corresponde a uma mistura de água com frações de álcool etílico, resultantes do método de separação.Portanto, a alternativa correta é D.Questão 13
solução aquosa.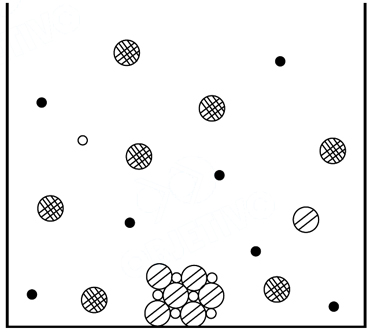
 representam diferentes espécies químicas. Moléculas de solventes não foram representadas. Considere que as soluções dos reagentes iniciais são representadas por
representam diferentes espécies químicas. Moléculas de solventes não foram representadas. Considere que as soluções dos reagentes iniciais são representadas por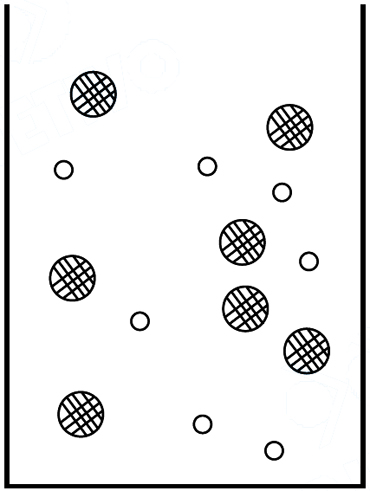
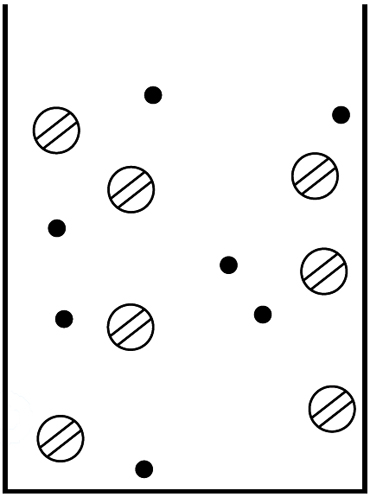 Assim, qual das seguintes equações químicas pode representar, de maneira coerente, tal transformação?
Assim, qual das seguintes equações químicas pode representar, de maneira coerente, tal transformação?- A) H+ + Cl– + Na+ + OH– ↔ Na+ + Cl– + H2O
- B) 2Na+ + CO32– + 2H++ 2Cl–↔ 2Na+ + 2Cl– + H2O + CO2
- C) Ag+ + NO3– + Na+ + Cl– ↔ AgCl + Na+ + NO3–
- D) Pb2+ + 2NO3– + 2H+ + 2Cl– ↔ PbCl2 + 2H+ + 2NO3–
FAZER COMENTÁRIO- E) NH4+ + Cl– + H2O ↔ NH4OH + H+ + Cl–
A alternativa correta é letra C
Para ambos os reagentes a proporção entre eles é de 1:1 nos recipientes.A mistura resultante mostra a formação de retículo sólido na proporção de íons em 1:1.Portanto, a alternativa que se adequa a condição da solução apresentada na figura é a que indica a formação de um sólido na proporção iônica de 1:1. Na formação de PbCl2 , temos uma proporção de 1:2 enquanto que na formação de AgCl de 1:1.14) Quando misturamos substâncias como (H2O) e (CCl4) obtemos uma:
- A) Substância pura.
- B) Substância composta.
- C) Mistura homogênea.
- D) Mistura heterogênea.
FAZER COMENTÁRIO- E) Mistura racêmica.
A alternativa correta é letra D
A adição de H2O e CCl4 resulta em uma mistura heterogênea de duas fases. Isso ocorre porque a água é uma substância polar e o tetracloreto de carbono é apolar, resultando em uma mistura imiscível.Portanto, a resposta correta é a alternativa D.15) Na mesma condição de pressão foram preparadas as seguintes soluções. Em um béquer (béquer 1) foram adicionados 1 kg de água e 1 mol de sacarose (C12H22O11). A mistura foi agitada dando origem a uma solução 1. Em outro béquer (béquer 2) foram adicionados 1 kg de água e 1 mol de cloreto de sódio (NaCl). A mistura foi agitada dando origem a uma solução 2. Em outro béquer (béquer 3) foram adicionados 1 kg de água e 1 mol de glicose (C6H12O6). A mistura foi agitada dando origem a uma solução 3.
- A) A diminuição do ponto de congelamento do solvente na solução 1 é maior que na solução 3.
- B) O aumento do ponto de ebulição do solvente na solução 2 é menor que na solução 1.
- C) A diminuição da pressão de vapor do solvente da solução 2 é duas vezes maior que da solução 1.
- D) A diminuição da pressão de vapor do solvente da solução 2 é igual ao da solução 3.
FAZER COMENTÁRIO- E) O aumento do ponto de ebulição do solvente da solução 1 é duas vezes maior que da solução 3.
A alternativa correta é letra C
Todas as três soluções apresentam a mesma molalidade (concentração em mol de soluto por massa de solvente, em kg). E em relação ao soluto, tem-se que nas soluções 1 e 3 eles são covalentes, tendo, portanto, o mesmo efeito nas propriedades coligativas da solução formada; enquanto que o NaCl da solução 2 é iônico, aumentando o número de partículas dissolvidas na solução (o fator que está diretamente ligada as propriedades coligativas é o fator de Van't Hoff, e este depende diretamente do número de partículas em solução) . Esse fato tem como consequência o maior abaixamento do ponto de congelamento, diminuição da pressão de vapor (aumento do ponto de ebulição) da solução 2, sendo que na 1 e 3, o efeito dessas propriedades é o mesmo nas duas.Portanto, a resposta correta é a alternativa C.16) Três copos, A, B e C, possuem a mesma quantidade de água. São dissolvidos 18,0 g de glicose, 6,0 g de uréia e 34,2 g de sacarose, respectivamente nos copos A, B e C. A solução ou as soluções que apresentam maior pressão de vapor à mesma temperatura é ou são:
- A)CON2H4 = 60g/mol; M(sacaros
- B)C12H22O11 = 342g/mol)
FAZER COMENTÁRIO
A alternativa correta é letra E
As soluções foram todas preparadas com a adição de 0,1mol (razão entre a massa de soluto e sua respectiva massa molar) de cada soluto por frasco. Assim, apresentam a mesma molaridade (quantidade em mol de soluto por volume de solução) e todos os solutos adicionados são covalentes, ou seja, não formam íons em solução. Dessa forma, a pressão de vapor em todas as soluções será a mesma em uma determinada temperatura.Portanto, a resposta correta é a alternativa E.17) As legiões romanas que conquistaram grande parte do mundo eram obrigadas a cobrir longas distâncias, marchando em menor tempo possível.
- A) seu isômero funcional é o éter dietílico;
- B) é um ácido carboxílico fraco e, por esse motivo, sua dissociação é considerada completa;
- C) ao reagir com o hidróxido de sódio, produz um sal cujo cátion sofre hidrólise em meio aquoso;
- D) a solução aquosa do seu sal de sódio apresenta pH menor que 7;
FAZER COMENTÁRIO- E) a oxidação do etanol é o método mais utilizado para a produção do ácido acético.
A alternativa correta é letra E
O ácido acético é um ácido fraco, indicando assim que sua dissociação não é completa. e também, por esse motivo, o sal formado por ânios acetato com o cátion sódio sofre reação de hidrólise (somente o ânion), resultando uma solução básica.A principal forma de produzir o ácido acético é por meio da oxidação do etanol, segundo a reação abaixo:C2H5OH + O2 → CH3 - COOH + H2OPortanto, a resposta correta é a alternativa E.Questão 18
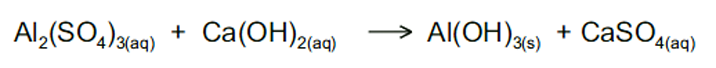 Assinale a alternativa que apresenta a concentração de sulfato de cálcio, em mol.L-1, presente na solução final.
Assinale a alternativa que apresenta a concentração de sulfato de cálcio, em mol.L-1, presente na solução final.- A) 0,002.
- B) 0,004.
- C) 0,020.
- D) 0,030.
FAZER COMENTÁRIO- E) 0,040.
A alternativa correta é letra B
Esta é uma questão de mistura de soluções com ocorrência de reação química. Primeiramente, deve-se balancear a equação que representa a reação ocorrida:A partir dos volumes e concentrações das soluções adicionadas, podemos determinar o número de mols de cada reagente que foi adicionado à solução, utilizando:.Para o sulfato de alumínio, temos:E para o hidróxido de cálcio, temos:Sendo o hidróxido de cálcio o reagente em menor quantidade (em número de mols), é o reagente limitante, enquanto que, o sulfato de alumínio é o reagente em excesso. Assim, pela estequiometria da reação, a quantidade de hidróxido de cálcio que reage é a mesma de sulfato de cálcio (CaSO4) que é produzido. Ou seja, ao final da reação, serão produzidos 0,003 mols de CaSO4. A fim de se determinar a concentração final, basta utilizar a seguinte relação:Portanto, a alternativa correta é B.Questão 19
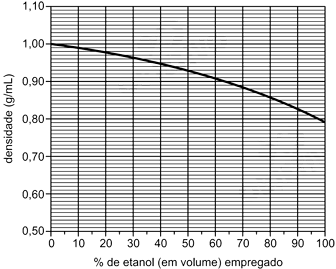 Se 50 mL de etanol forem misturados a 50 mL de água, a 20°C, o volume da mistura resultante, a essa mesma temperatura, será de, aproximadamente,Se 50 mL de etanol forem misturados a 50 mL de água, a 20°C, o volume da mistura resultante, a essa mesma temperatura, será de, aproximadamente,
Se 50 mL de etanol forem misturados a 50 mL de água, a 20°C, o volume da mistura resultante, a essa mesma temperatura, será de, aproximadamente,Se 50 mL de etanol forem misturados a 50 mL de água, a 20°C, o volume da mistura resultante, a essa mesma temperatura, será de, aproximadamente,- A) 76 mL.
- B) 79 mL.
- C) 86 mL.FAZER COMENTÁRIO
- D) 89 mL.
- E) 96 mL.
A alternativa correta é letra E
A partir do gráfico apresentado, observamos que a densidade de solução de água pura é de 1,00 g/mL e a densidade de álcool puro é 0,79 g/mL. Dessa forma, em uma mistura de 50 mL de água e 50 mL de etanol, a massa de cada substancia será:
Etanol:
Água:
A massa da mistura será:
De acordo com o gráfico, a densidade para a mistura com 50% de etanol é 0,93 g/mL. Logo:
A resposta correta é letra E, aproximadamente 96 mL.Continua após a publicidade..20) Sucos são misturas de substâncias específicas a cada fruta, como é o caso da laranja que é a mistura de vitamina C, ácido fólico e flavonóides. Quando uma mistura é homogênea tem-se uma solução. Desta forma assinale a alternativa verdadeira.
- A) Quanto menor a quantidade de soluto presente num determinado volume de solução, mais concentrada será essa solução.
- B) Partes por milhão em massa (ppm) é uma forma de expressar a concentração de soluções saturadas de sólidos em líquidos.
- C) Soluções saturadas são estáveis e apresentam quantidade máxima de solvente possível para dissolver uma determinada quantidade de soluto, a uma dada temperatura.
- D) O coeficiente de solubilidade é a quantidade de soluto necessária para saturar uma quantidade padrão de solvente a uma determinada temperatura.
FAZER COMENTÁRIO- E) O coeficiente de solubilidade não se altera com a temperatura.
« Anterior 1 2 3 4 … 7 Próximo »A alternativa correta é letra D
Em relação à definição de mistura homogênea, ou solução, tem-se que quanto maior a quantidade de soluto dissolvido, maior será a concentração , esta expressa em massa de soluto por volume de solução, ou massa de soluto por massa de solução com unidades ppm, por exemplo.Um termo relacionado à solução é o coeficiente de solubilidade, que indica a quantidade máxima de soluto é capaz de ser solubilizado com determinada massa de solvente, a uma dada temperatura.Portanto, a resposta correta é a alternativa D. - B) Partes por milhão em massa (ppm) é uma forma de expressar a concentração de soluções saturadas de sólidos em líquidos.
- B) 0,004.
- B) é um ácido carboxílico fraco e, por esse motivo, sua dissociação é considerada completa;
- A) seu isômero funcional é o éter dietílico;
- B) O aumento do ponto de ebulição do solvente na solução 2 é menor que na solução 1.
- B) Substância composta.
- B) 2Na+ + CO32– + 2H++ 2Cl–↔ 2Na+ + 2Cl– + H2O + CO2
- B) 28% de álcool.
