Questões Sobre Soluções - Química - 1º ano do ensino médio
31) A água boricada é uma solução aquosa de ácido bórico, H3BO3, a 3% (m/V). Expressando-se essa concentração em mg de soluto por mL de solução, obtém-se o valor
- A) 30.
- B) 0,3.
- C) 300.
- D) 0,03.
- E) 3.
A alternativa correta é letra A
A resposta correta é a alternativa a.
Cálculo da massa de ácido boricado:solução 3%
3% = 3g de ácido boricado em 100 ml de solução:
Conversão para miligrama
1000 mg = 1 g
logo teremos 3000 mg de ácido bórico em 100 ml
Cálculo da massa em 1 ml
3000/100 = 30 mg/ml
Cálculo da massa de ácido boricado:solução 3%
3% = 3g de ácido boricado em 100 ml de solução:
Conversão para miligrama
1000 mg = 1 g
logo teremos 3000 mg de ácido bórico em 100 ml
Cálculo da massa em 1 ml
3000/100 = 30 mg/ml
32)
- A) a concentração dos íons em 100 mL de plasma é dez vezes menor do que em 1000 mL do mesmo plasma.
- B) a concentração total de íons no plasma sangüíneo é de 1,49 x 10-3 mol.L-1.
- C) a concentração total de íons no plasma sangüíneo é de 10,4 x 10-3 mol.L-1.
- D) a concentração dos íons independe do volume da amostra de plasma.
FAZER COMENTÁRIO- E) a concentração dos íons não é afetada quando se adiciona água à amostra de plasma.
A alternativa correta é letra D
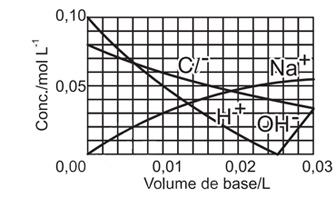
A concentração é uma unidade universal e independe do volume da amostra, portanto a concentração dos íons em 100 mL de plasma é a mesma que em 1L. A concentração dos íons só se altera quando é adicionado solvente na solução de plasma.33) Uma solução aquosa de NaOH (base forte), de concentração 0,10 mol L–1, foi gradualmente adicionada a uma solução aquosa de HCl (ácido forte), de concentração 0,08 mol L–1. O gráfico que fornece as concentrações das diferentes espécies, durante essa adição é
FAZER COMENTÁRIO- A)
- B)
- C)
- D)
- E)
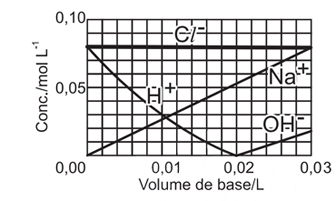
A alternativa correta é letra A
Foram adicionados, em um recipiente que já continha HCl a 0,08mol/L, NaOH a 0,10mol/L.A reação que ocorre é:H+(aq)+Cl-(aq)+Na+(aq)+OH-(aq) H2O(l)+Na+(aq)+Cl-(aq)Dessa forma, no início existia uma concentração igual a 0,08mol/L de HCl e nenhum NaOH no recipiente.Ao ser adicionado o NaOH:- a concentração do íon Cl- diminui gradualmente por conta de um aumento no volume do sistema.- a concentração de íons Na+ aumenta gradualmente, pois antes este não existia na solução.- a concentração do íon H+ diminui gradualmente até sua neutralização total, já que estamos adicionando uma base que contém íons OH-. O ponto 0,02 L, no gráfico, representa o momento da neutralização total onde as concentrações dos íons Na+ e Cl- são iguais.Após a neutralização total, continua-se adicionando NaOH e:- a concentração de íons OH- aumenta, bem como a de Na+.Portanto, a alternativa A é que melhor representa a concentração das espécies durante a adição de NaOH.Questão 34
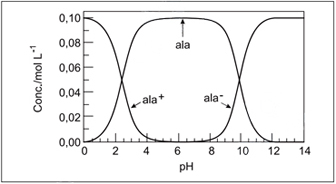 Quando [ala] = 0,08 mol L–1, [ala+] = 0,02 mol L–1 e [ala–] for desprezível, a concentração hidrogeniônica na solução, em mol L–1, será aproximadamente igual a
Quando [ala] = 0,08 mol L–1, [ala+] = 0,02 mol L–1 e [ala–] for desprezível, a concentração hidrogeniônica na solução, em mol L–1, será aproximadamente igual a- A) 10–11
- B) 10–9
- C) 10–6
- D) 10–3
FAZER COMENTÁRIO- E) 10–1
A alternativa correta é letra D
Observando no gráfico, para as concentrações de [ala] = 0,08mol.L-1 e [ala+] = 0,02 mol.L-1, o pH é igual a 3.Aplicando o valor do pH na equação pH = -log [H+], podemos encontrar a concentração hidrogeniônica da solução:pH = -log [H+]3 = -log [H+][H+] = 10-3 mol.L-1.35) O eletrólito empregado em baterias de automóvel é uma solução aquosa de ácido sulfúrico. Uma amostra de 5,0mL da solução de uma bateria requer 25mL de hidróxido de sódio 0,6mol/L para sua neutralização completa. A concentração do ácido, em mol/L, na solução da bateria, é:
- A) 6,0
- B) 4,5
- C) 3,0
- D) 2,0
FAZER COMENTÁRIO- E) 1,5
A alternativa correta é letra E
A reação de neutralização que ocorre entre o ácido sulfúrico e o hidróxido de sódio é a seguinte:H2SO4 (aq) + 2 NaOH (aq) → Na2(SO4) (aq) + 2 H2OComo pode ser visto, a razão molar entre o ácido e a base é de 1:2.Na solução de hidróxido de sódio, tem-se a seguinte quantidade molar de base:quantidade molar de base = 0,6mol/L x 0,025L = 0,015mol de NaOHAssim, mantendo a razão estequiométrica, tem-se que a quantidade molar de ácido é de 0,0075mol (0,015 /2).Como são 5mL de solução ácida, a concentração é de :C = 0,0075mol / 0,005LC = 1,5mol/L de H2SO4Portanto, a resposta correta é a alternativa E.36) Em intervenções cirúrgicas, é comum aplicar uma tintura de iodo na região do corpo onde será feita a incisão. A utilização desse produto deve-se à sua ação anti-séptica e bactericida. Para 5 litros de etanol, densidade 0,8 g/mL, a massa de iodo sólido, em gramas, que deverá ser utilizada para obter uma solução que contém 0,50 mol de I2 para cada quilograma de álcool, será de
- A) 635
- B) 508
- C) 381
- D) 254
FAZER COMENTÁRIO- E) 127
A alternativa correta é letra B
Dada a massa molecular do I2 igual a 254 g, temos que a masse de I2 em 0,5 mol é:1 mol I2 → 254 g0.5 mol I2 → m1m1 = 127 gA partir da densidade do álcool, calculamos qual a massa de etanol em 5L:d = m/v0,8 g/mL = m/ 5000 mLm = 4000 gA massa de iodo na solução alcoolica é:1000 g → 127 g I24000 g → m I2m I2 = 508 gA alternativa correta é B.
Questão 37
(uenf.br/uenf/centros/cct/qambiental/ag_dura.html. Acesso em: 03.05.2013. Adaptado)Considere a tabela de classificação da água.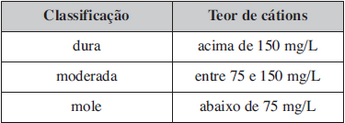 Analisando a tabela, conclui-se, corretamente, que a água é considerada
Analisando a tabela, conclui-se, corretamente, que a água é considerada FAZER COMENTÁRIO
FAZER COMENTÁRIO- A) moderada, quando a concentração está entre 7,5 e 15 ppm (m/m).
- B) moderada, quando a concentração está entre 75 e 150 ppb (m/m).
- C) mole, quando a concentração está abaixo de 0,75 ppm (m/m).
- D) dura, quando a concentração está acima de 150 ppm (m/m).
- E) dura, quando a concentração está acima de 150 ppb (m/m).
A alternativa correta é letra D
Solução aquosa 1 ppm corresponde a 1 mg/L.
dura --------acima de 150 ppm
moderada---------- entre 75 e 150 ppm
mole------------ abaixo de 75 ppmQuestão 38
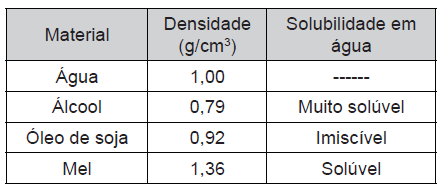 Considerando o objetivo a ser atingido, identifique a alternativa que traz uma afirmação CORRETA sobre a disposição dos líquidos no tubo.FAZER COMENTÁRIO
Considerando o objetivo a ser atingido, identifique a alternativa que traz uma afirmação CORRETA sobre a disposição dos líquidos no tubo.FAZER COMENTÁRIO- A) A ordem correta de colocação dos líquidos é mel, álcool, água e óleo.
- B) A ordem de colocação dos líquidos no tubo não altera o resultado final.
- C) O número de camadas continua o mesmo após alguns dias.
- D) O óleo deve ser colocado sobre a água para a separação das camadas.
A alternativa correta é letra D
Para resolver esta questão é fundamental que saibamos o que significa imiscível.
Líquidos que não se misturam são chamados de imiscíveis.
Com base nas informações da tabela temos que água e óleo não se misturam.
Sendo assim, como todos as outras substâncias são solúveis em água, o óleo deve ficar sobre a água, até porque a densidade do óleo de soja é menor que a densidade da água, o que nos leva inevitavelmente a esta ordem.
Em relação as outras alternativas:
Alternativa a), esta ordem não vai existir, já que a densidade dos líquidos não corresponde a isso, de baixo para cima a ordem devido a densidade será: mel, água, óleo e álcool, onde mel e água vão se misturar.
Em relação a ordem não importar isso é falso, pois caso coloquemos os líquidos que são solúveis em água, é possível que antes de ocorrer a organização pela densidade os líquidos se misturem a água, e por fim teremos apenas a mistura de água com álcool e mel, e óleo, apenas os dois.
Em relação a afirmação de que dentre alguns dias haverá o mesmo número de camadas, pelas discussões acima é óbvio que isso é falso, pois o mel vai se misturar com a água.
Alternativa D)
39) Quando o pH da água da chuva fica abaixo de 5,0 ocorre o fenômeno denominado chuva ácida. Assinale a alternativa na qual a concentração de HNO3 (massa molar = 63 g.mol–1), isoladamente, seria suficiente para que se considerasse a chuva como ácida.
- A) 7.10–2 mg.L–1.
- B) 10–3 mM.
- C) 7.10–3 g.L–1.
FAZER COMENTÁRIO- D) 7.10–6 % (m/m).
- E) 2.10–7 M.
A alternativa correta é letra C
Primeiramente, devemos identificar o HNO3 como um ácido forte. Logo, para que o pH da chuva seja igual a 5, a concentração do ácido deve ser de 10-5 mol/L. Fazendo o cálculo em termos de massas para um litro de chuva, obtemos:1 mol de HNO3 ----- 63,0 g10-5 mols de HNO3 --- x gx = 6,3 . 10-4 g ou 0,63 mg de HNO3.Qualquer massa maior que essa em 1 litro de chuva, gera uma concentração maior do que 10-5 mol/L de ácido, portanto um pH < 5.Como 7.10-3 g > 6,3 . 10-4 g, a alternativa C é a correta.Continua após a publicidade..Questão 40
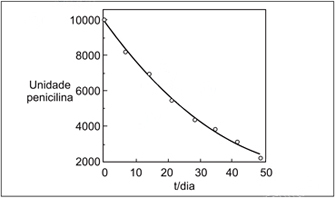 * Uma unidade de penicilina G corresponde a 0,6μg dessa substância.Supondo-se como aceitável uma atividade de 90% da inicial, o prazo de validade da solução seria de
* Uma unidade de penicilina G corresponde a 0,6μg dessa substância.Supondo-se como aceitável uma atividade de 90% da inicial, o prazo de validade da solução seria de- A) 4 dias
- B) 10 dias
- C) 24 dias
- D) 35 dias
FAZER COMENTÁRIO- E) 49 dias
« Anterior 1 2 3 4 5 6 7 Próximo »A alternativa correta é letra A
A quantidade inicial, em unidades de penicilina (G), é igual a 10000. Sabendo que é aceitável uma atividade inicial de 90% da inicial, temos:10 000 G ----------- 100%x ----------- 90%x = 9 000 G.Observando no gráfico, 9 000 G corresponde a um prazo de menos de dez dias de validade, sendo, portanto, 4 dias de prazo de validade da solução. Alternativa A. - B) 10 dias
- B) 508
- B) 4,5
- B) 10–9
- B) a concentração total de íons no plasma sangüíneo é de 1,49 x 10-3 mol.L-1.
