Continua após a publicidade..
Uma solução aquosa de NaOH (base forte), de concentração 0,10 mol L–1, foi gradualmente adicionada a uma solução aquosa de HCl (ácido forte), de concentração 0,08 mol L–1. O gráfico que fornece as concentrações das diferentes espécies, durante essa adição é
- A)
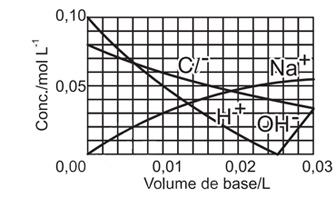
- B)
- C)
- D)
- E)
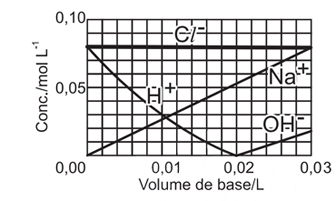
Resposta:
A alternativa correta é letra A
Foram adicionados, em um recipiente que já continha HCl a 0,08mol/L, NaOH a 0,10mol/L.
A reação que ocorre é:
H+(aq)+Cl-(aq)+Na+(aq)+OH-(aq) H2O(l)+Na+(aq)+Cl-(aq)
Dessa forma, no início existia uma concentração igual a 0,08mol/L de HCl e nenhum NaOH no recipiente.
Ao ser adicionado o NaOH:
- a concentração do íon Cl- diminui gradualmente por conta de um aumento no volume do sistema.
- a concentração de íons Na+ aumenta gradualmente, pois antes este não existia na solução.
- a concentração do íon H+ diminui gradualmente até sua neutralização total, já que estamos adicionando uma base que contém íons OH-. O ponto 0,02 L, no gráfico, representa o momento da neutralização total onde as concentrações dos íons Na+ e Cl- são iguais.
Após a neutralização total, continua-se adicionando NaOH e:
- a concentração de íons OH- aumenta, bem como a de Na+.
Portanto, a alternativa A é que melhor representa a concentração das espécies durante a adição de NaOH.

Deixe um comentário