Questões Sobre 1ª Lei da Termodinâmica - Física - 2º ano do ensino médio
1) De acordo com a primeira lei da termodinâmica se, durante um processo isotérmico sofrido por um gás ideal de massa fixa, o gás libera uma quantidade de calor cujo módulo é de 50 cal então a variação de energia interna e o trabalho realizado pelo gás neste processo são, respectivamente:
- A) 0 cal e 50 cal
- B) 50 cal e 0 cal
- C) 0 cal e 0 cal
- D) 50 cal e -50 cal
- E) 0 cal e -50 cal
Como o processo é isotérmico, sabemos que a energia interna é nula (ΔU = 0). Ademais, o gás libera 50 cal de calor, portanto, Q = -50 cal.
Assim:
ΔU = Q - W
0 = -50 - W
W = -50 J
2) Imagine que um gás ideal passe por um processo que tenha como resultado uma variação em sua energia interna ΔU igual ao trabalho realizado, e que não tenha havido troca de calor no processo. Se ΔU > 0, ou seja, a energia interna do gás aumenta, pode-se classificar o processo como
- A) compressão adiabática.
- B) expansão adiabática.
- C) compressão isotérmica.
- D) expansão isotérmica.
- E) expansão isobárica
A alternativa correta é letra A) compressão adiabática.
Ausência de troca de calor (Q = 0) = processo adiabático.
ΔU = Q - W
ΔU = 0 - W
ΔU = -W
Se ΔU > 0, então W < 0.
Trabalho negativo = compressão.
3) (FUNREI MG) De acordo com os conceitos da Termodinâmica, é correto afirmar que
- A) quanto maior o calor específico de um corpo melhor condutor de calor ele é.
- B) o calor específico dos sólidos é menor que o dos líquidos.
- C) o calor específico de uma substância depende de sua temperatura.
- D) o calor específico de um gás a volume constante é maior que a pressão constante.
A alternativa correta é letra C) o calor específico de uma substância depende de sua temperatura.
Estritamente falando, o calor específico depende da temperatura e das condições nas quais a energia é transferida ao sistema.
Questão 4
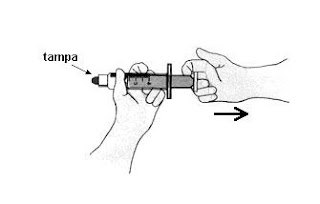
Considere o ar como um gás ideal. Sabe-se que, para um gás ideal, a energia interna é proporcional à sua temperatura. Com base nessas informações, é CORRETO afirmar que, no interior da seringa,
- A) a pressão do ar aumenta e sua temperatura diminui.
- B) a pressão do ar diminui e sua temperatura aumenta.
- C) a pressão e a temperatura do ar aumentam.
- D) a pressão e a temperatura do ar diminuem.
A alternativa correta é letra D) a pressão e a temperatura do ar diminuem.
∆U = Q – W (fórmula da variação de energia interna)
Como a seringa foi puxada rapidamente não houve tempo de acontecer troca de calor efetiva, ou seja, ocorreu uma transformação adiabática (Q = 0). Logo:
∆U = 0 – W
∆U = -W
Toda vez que ocorre a expansão de um gás, o trabalho (W) realizado é positivo. Assim, concluímos que a energia interna é necessariamente negativa. Como a energia interna é proporcional à temperatura, fica evidente que a energia interna diminuiu.
P1.V1/T1 = P2.V2/T2 (fórmula do gás ideal)
Diante disso, já sabemos que o volume aumentou e a temperatura diminuiu. Para que haja balanço entre as equações acima, é necessário que a pressão diminua.
5) Numa transformação gasosa reversível, a variação da energia interna é de +300 J. Houve compressão e o trabalho realizado pela força de pressão do gás é, em módulo, 200 J. Então, é verdade que o sistema:
- A) cedeu 500 J de calor ao meio
- B) cedeu 100 J de calor ao meio
- C) recebeu 500 J de calor do meio
- D) recebeu 100 J de calor do meio
- E) sofreu uma transformação adiabática
A alternativa correta é letra D) recebeu 100 J de calor do meio
Quando o gás é comprimido, a variação do volume é negativa implicando num trabalho negativo (-200 J), ou seja, o sistema recebe calor.
ΔU = Q - W
300 = Q - (-200)
Q = 300-200
Q = 100 J
6) Sendo U a energia interna, Q o calor trocado com a vizinhança, e W o trabalho realizado em uma expansão adiabática livre (pressão nula) de um gás ideal, é CORRETO afirmar que
- A) ∆U = 0, Q = 0, W = 0.
- B) ∆U = 0, Q ≠ 0, W ≠ 0.
- C) ∆U ≠ 0, Q = 0, W = 0.
- D) ∆U ≠ 0, Q = 0, W ≠ 0.
- E) ∆U ≠ 0, Q ≠ 0, W = 0.
A alternativa correta é letra A) ∆U = 0, Q = 0, W = 0.
Quando um gás é comprimido ou expandido sem trocar calor (Q = 0) com a vizinhança, dizemos que o gás sofreu uma transformação adiabática. Na expansão livre o gás se expande sem sofrer resistência e, portanto, não existe trabalho realizado (W = 0). Como ∆U = Q - W, então ∆U = 0.
7) Sabe-se que a energia média de translação das moléculas de um gás é dada por Ec = (3/2)KT, em que K é a constante de Boltzmann, e T, a temperatura do gás. Considere uma amostra de um gás ideal monoatômico, cuja energia interna é apenas a energia cinética de translação de suas moléculas.
- A) Sabendo-se que o número de moléculas é N = 2,0 x 10²⁴ moléculas e que sua temperatura é de 27 ºC, DETERMINE o valor da energia interna U dessa amostra. (Considere K = 1,4 x 10⁻²³ J/K.)
- B) Uma quantidade de calor ∆Q = 2,0 x 10³ cal é fornecida à amostra gasosa anteriormente referida. Essa amostra se expande, realizando um trabalho ∆W = 2,4 x 10³ J. DETERMINE a variação ∆U da energia interna do gás nessa transformação. (Considere 1 cal = 4,2 J.)
- C) DETERMINE a temperatura final da amostra gasosa após sofrer a transformação descrita no item anterior.
A)
T = 27ºC = 300 K
A energia interna de um gás ideal é devida apenas à energia cinética de translação dos átomos e o seu valor é dado por:
U = (3/2).N.K.∆T
U = (3/2).2.10²⁴.1,4 x 10⁻²³.3.10²
U = 12,6.10³ J ou 1,26.10⁴ J
B)
Q = 2.10³ cal = 2.10³ x 4,2 = 8,4.10³ J
∆U = Q - W
∆U = 8,4.10³ - 2,4.10³
∆U = 6.10³ J
C)
U = (3/2).N.K.∆T
6.10³ = (3/2).2.10²⁴.1,4 x 10⁻²³.(Tf - 3.10²)
Tf - 3.10² = 6.10³/4,2.10
Tf = 1,43.10² + 3.10²
Tf = 4,43.10² K ou 443 K
Questão 8
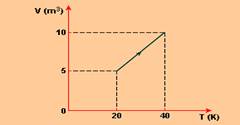
Sabendo-se que nessa transformação o gás absorve 250 J de calor, pode-se afirmar que a variação de sua energia interna é de
- A) 100 J.
- B) 150 J.
- C) 250 J.
- D) 350 J.
- E) 400 J.
A alternativa correta é letra B) 150 J.
W = P.ΔV
W = 20.(10-5)
W = 20.5
W = 100 J
ΔU = Q – W
ΔU = 250 – 150
ΔU = 150 J
9) No filme “Kenoma”, uma das personagens, Lineu, é um artesão que sonha construir um motor que não precise de energia para funcionar. Se esse projeto tivesse sucesso, estaria necessariamente violada a:
- A) Primeira Lei de Newton.
- B) Lei da Conservação da Energia.
- C) Lei da Conservação da Quantidade de Movimento.
- D) Primeira Lei de Kirchhoff.
- E) Lei de Snell-Descartes.
A alternativa correta é letra B)Lei da Conservação da Energia.
A energia pode ser transformada ou transferida, mas nunca criada ou destruída.
10) Um sistema termodinâmico ao passar de um estado inicial para um estado final, tem 200 J de trabalho realizado sobre ele, liberando 70 cal. Usando a 1ª lei da termodinâmica e considerando que 1 cal equivale a 4,19 J, indique o valor, com os respectivos sinais, das seguintes grandezas:
- A)W =
- B)Q =
- C)ΔU =
Resposta correta: A) -200J B)-293,3J C)-93,3J.
W = -200 J (negativo, tendo em vista que a variação de volume do gás é negativa, ao passar do estado inicial para o estado)
Q = -70 cal (negativo, pois está cedendo calor)
Q = -70.4,19 = -293,3 J
ΔU = Q - W
ΔU = -293,3 - (-200)
ΔU = -93,3 J
