Uma seringa, com a extremidade fechada, contém uma certa quantidade de ar em seu interior. Sampaio puxa, rapidamente, o êmbolo dessa seringa, como mostrado nesta figura:
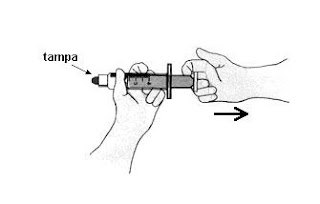
Considere o ar como um gás ideal. Sabe-se que, para um gás ideal, a energia interna é proporcional à sua temperatura. Com base nessas informações, é CORRETO afirmar que, no interior da seringa,
- A) a pressão do ar aumenta e sua temperatura diminui.
- B) a pressão do ar diminui e sua temperatura aumenta.
- C) a pressão e a temperatura do ar aumentam.
- D) a pressão e a temperatura do ar diminuem.
Resposta:
A alternativa correta é letra D) a pressão e a temperatura do ar diminuem.
∆U = Q – W (fórmula da variação de energia interna)
Como a seringa foi puxada rapidamente não houve tempo de acontecer troca de calor efetiva, ou seja, ocorreu uma transformação adiabática (Q = 0). Logo:
∆U = 0 – W
∆U = -W
Toda vez que ocorre a expansão de um gás, o trabalho (W) realizado é positivo. Assim, concluímos que a energia interna é necessariamente negativa. Como a energia interna é proporcional à temperatura, fica evidente que a energia interna diminuiu.
P1.V1/T1 = P2.V2/T2 (fórmula do gás ideal)
Diante disso, já sabemos que o volume aumentou e a temperatura diminuiu. Para que haja balanço entre as equações acima, é necessário que a pressão diminua.

Deixe um comentário