Continua após a publicidade..
O esquema representa um calorímetro utilizado para a determinação do valor energético dos alimentos.
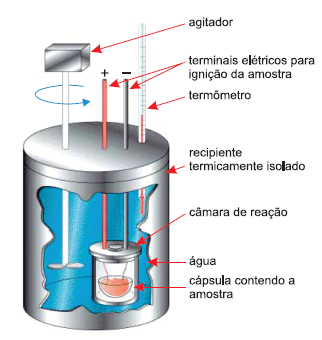
(http://quimica2bac.wordpreess. Adaptado.)
A tabela nutricional de determinado tipo de azeite de oliva traz a seguinte informação: “Uma porção de 13 mL (1 colher de sop
- A) equivale e 108 kcal.” Considere que o calor específico da água seja 1 kcal. kg–1. °C–1 e que todo o calor liberado na combustão do azeite seja transferido para a água. Ao serem queimados 2,6 mL desse azeite, em um calorímetro contendo 500 g de água inicialmente a 20,0°C e à pressão constante, a temperatura da água lida no termômetro deverá atingir a marca de
Resposta:
A alternativa correta é letra D
Primeiramente vamos separar as informações que temos das quais queremos obter. Do enunciado é possível concluir o seguinte:
- 13 ml do azeite equivale a 108 kcal
- Apenas 2,6 ml desse azeite é usado no processo
- A massa de água usada no processo é de 500 g (0,5 kg)
- O calor específico da água é de 1 kcal. kg–1. °C–1
- A temperatura inicial da água é de 20 °C
E o que queremos obter é a temperatura final da água.
Primeiramente vamos descobrir a quantidade de kcal que equivale a 2,6 ml do azeite, ou seja, quando o azeite é queimado, quantos kcal ele libera?
Para isso basta fazermos uma regrinha de três:
13 ml - 108 kcal
2,6 ml - x
13x ml = 2,6*108 kcal*ml => x = 21,6 kcal
Um sistema é dito estar em equilíbrio térmico quando a soma dos seus calores internos é nulo.
Ao término do processo sabemos que o sistema água+azeite vai estar em equilíbrio térmico, sendo assim a soma dos seus calores deve ser nulo, ou seja,
Qágua + Qazeite = 0 => Qágua = -Qazeite
Mas, pela regra de três acima, sabemos exatamente a quantidade de calor envolvida na queima do azeite, temos que ele libera 21,6 kcal, sendo assim,
Qazeite = -21,6 kcal
Qágua = -Qazeite
Qágua = -(-21,6 kcal)
Qágua = 21,6 kcal
Usando que Q = m*c*ΔT
Onde Q é o calor, m é a massa, c é o calor específico e ΔT é diferença de temperatura entre a inicial e a final temos:
Qágua = (500 g)(1 kcal. kg–1. °C–1)(Tf - 20 °C)
(0,5 kg)(1 kcal. kg–1. °C–1)(Tf - 20 °C) = 21,6 kcal
Tf - 20 °C = 43,2 °C => Tf = 63,2 °C
Alternativa D)
- 13 ml do azeite equivale a 108 kcal
- Apenas 2,6 ml desse azeite é usado no processo
- A massa de água usada no processo é de 500 g (0,5 kg)
- O calor específico da água é de 1 kcal. kg–1. °C–1
- A temperatura inicial da água é de 20 °C
E o que queremos obter é a temperatura final da água.
Primeiramente vamos descobrir a quantidade de kcal que equivale a 2,6 ml do azeite, ou seja, quando o azeite é queimado, quantos kcal ele libera?
Para isso basta fazermos uma regrinha de três:
13 ml - 108 kcal
2,6 ml - x
13x ml = 2,6*108 kcal*ml => x = 21,6 kcal
Um sistema é dito estar em equilíbrio térmico quando a soma dos seus calores internos é nulo.
Ao término do processo sabemos que o sistema água+azeite vai estar em equilíbrio térmico, sendo assim a soma dos seus calores deve ser nulo, ou seja,
Qágua + Qazeite = 0 => Qágua = -Qazeite
Mas, pela regra de três acima, sabemos exatamente a quantidade de calor envolvida na queima do azeite, temos que ele libera 21,6 kcal, sendo assim,
Qazeite = -21,6 kcal
Qágua = -Qazeite
Qágua = -(-21,6 kcal)
Qágua = 21,6 kcal
Usando que Q = m*c*ΔT
Onde Q é o calor, m é a massa, c é o calor específico e ΔT é diferença de temperatura entre a inicial e a final temos:
Qágua = (500 g)(1 kcal. kg–1. °C–1)(Tf - 20 °C)
(0,5 kg)(1 kcal. kg–1. °C–1)(Tf - 20 °C) = 21,6 kcal
Tf - 20 °C = 43,2 °C => Tf = 63,2 °C
Alternativa D)

Deixe um comentário