Questões Sobre Calorimetria - Física - 2º ano do ensino médio
51) Energia térmica, obtida a partir da conversão de energia solar, pode ser armazenada em grandes recipientes isolados, contendo sais fundidos em altas temperaturas. Para isso, pode-se utilizar o sal nitrato de sódio (NaNO3), aumentando sua temperatura de 300°C para 550°C, fazendo-se assim uma reserva para períodos sem insolação. Essa energia armazenada poderá ser recuperada, com a temperatura do sal retornando a 300°C. Para armazenar a mesma quantidade de energia que seria obtida com a queima de 1 L de gasolina, necessita-se de uma massa de NaNO3 igual aPoder calorífico da gasolina = 3,6 x 107 J/L Calor específico do NaNO3 = 1,2 x103 J/kg°C
- A) 4,32 kg.
- B) 120 kg.
- C) 240 kg.
- D) 3 x 104 kg.
FAZER COMENTÁRIO- E) 3,6 x 104 kg.
A alternativa correta é letra B
Queremos saber a massa de NaNO3 capaz de armazenar a mesma quantidade de calor liberada na queima de 1L de gasolina. De acordo com os dados, o poder calorífico da gasolina é 3,6 x 107 J/L, então 1 L de gasolina irá liberar 3,6 x 107 J de calor que será o mesmo que o armazenado pela massa M de NaNO3, aumentando sua temperatura de 300 °C para 550 °C, lembrando que:onde c é o calor específico do NaNO3 e é a variação da temperatura. é o calor que queremos dar à massa de NaNO3 para que ela tenha uma variação de temperaturaA partir disso temos a relação:Após as contas:A resposta correta é a "B"52) Segundo a Biblioteca Virtual Leite Lopes,
- A) 600.
- B) 300.
- C) 150.
- D) 50.
FAZER COMENTÁRIO- E) 10.
A alternativa correta é letra E
De acordo com o enunciado, a quantidade de calor liberada na queima de uma massa m de carvão deve ser igual ao calor consumido no aquecimento de 1 kg de água em 100ºC. A quantidade de calor envolvida no aquecimento da água é dada por:A quantidade de calor envolvida na queima de m kg de carvão é tal que:,em que C é o calor de combustão do carvão fornecido pelo enunciado. Assim,alternativa "E".53) Encerrado o trabalho, o cinegrafista pensou num banho… Desconsiderando perdas de calor para o corpo da banheira e para o ar, a mistura de 60 litros de água, inicialmente a 80ºC, com certa quantidade de água a 20ºC, resultaria em uma temperatura de 40ºC. Conhecidos o calor específico da água, 1 cal/(g.ºC), a densidade da água, 1 kg/L, a quantidade de água a 20ºC a ser despejada, em litros, seria
- A) 80.
- B) 90.
- C) 100.
- D) 120.
FAZER COMENTÁRIO- E) 140.
A alternativa correta é letra D
Desconsiderando perdas, podemos escrever, para duas substâncias quaisquer, a seguinte equação de conservação de energia:Como conhecemos a densidade das substâncias:Substituindo:Voltemos agora para o exercício. Como a única substância em análise é água, podemos fazer as simplificações:Substituindo pelos valores que conhecemos, onde o índice 1 se refere à água a 80ºC:Logo, a opção correta é a D.54) Um fogão, alimentado por um botijão de gás, com as características descritas no quadro abaixo, tem em uma de suas bocas um recipiente com um litro de água que leva 10 minutos para passar de 20°C a 100°C. Para estimar o tempo de duração de um botijão, um fator relevante é a massa de gás consumida por hora. Mantida a taxa de geração de calor das condições acima, e desconsideradas as perdas de calor, a massa de gás consumida por hora, em uma boca de gás desse fogão, é aproximadamente
- A) 8 g
- B) 12 g
- C) 48 g
- D) 320 g
- E) 1920 g
Características do botijão de gás Gás____________________________GLP Massa total______________________13 kg Calor de combustão_______________40 000 kJ/kgFAZER COMENTÁRIOA alternativa correta é letra C
Primeiro, calculemos a taxa de geração de calor do fogão. Para ferver 1L de água, temos o calor:m = 1 kg;c = 1 cal/g ºC ≅ 4.103 J/Kg ºC;ΔT = (100 - 20) = 80 ºC;⇒ ΔQ = m.c.ΔT = 1 . 4.103 . 80 = 3,2.105 J = 320 kJPortanto, temos a taxa:Δt = 10 min⇒ T = ΔQ/Δt = 32 kJ/min∴ Em 1h = 60 min, temos:ΔQ = 32 . 60 = 1920 kJComo são gerados 40 000 kJ a cada 1 kg de gás em combustão, temos que a massa consumida de gás durante 1h é:m = 1920 kJ / 40 000 kJ = 0,048 kg = 48 g55) Era 6 de agosto de 1945, 8h15 da manhã, no Japão, quando o Enola Gay, um bombardeiro B-29 americano lançou, contra a cidade de Hiroshima, o primeiro ataque atômico da história da humanidade, despejando sobre a cidade uma bomba atômica de 4 500 kg. A cidade foi arrasada, e 70 mil pessoas morreram nos primeiros segundos pós a explosão. Até hoje, o número de mortos decorrentes dessa operação está sendo contabilizado, e já ultrapassou 250 mil.
- A) 1 mil.
- B) 100 mil.
- C) 1 milhão.
- D) 10 bilhões.
FAZER COMENTÁRIO- E) 100 bilhões
A alternativa correta é letra D
A explosão de uma bomba de Hiroshima, que corresponde a 20 mil toneladas de TNT, libera a seguinte quantidade de energia:Q = 20000.109 = 2.1013 calUtilizando este calor para elevar a temperatura de uma massa m de água em 2ºC, teríamos:Q = m c ΔT ⇒ 2.1013 = m.1.2∴ m = 1.1013 gComo d = m/v, temos:1000 = 1.1013/v∴ v = 1010 L = 10 bilhões de litros de água.56) No início do século XX, Pierre Curie e colaboradores, em uma experiência para determinar características do recém-descoberto elemento químico rádio, colocaram uma pequena quantidade desse material em um calorímetro e verificaram que 1,30 grama de água líquida ia do ponto de congelamento ao ponto de ebulição em uma hora. A potência média liberada pelo rádio nesse período de tempo foi, aproximadamente,
FAZER COMENTÁRIO- A) 0,06 W
- B) 0,10 W
- C) 0,14W
- D) 0,18 W
- E) 0,22 W
A alternativa correta é letra C
podemos calcular o calor fornecido a água da seguinte maneira:
Sabemos que57) Uma mesma quantidade de calor Q é fornecida a massas iguais de dois líquidos diferentes, 1 e 2. Durante o aquecimento, os líquidos não alteram seu estado físico e seus calores específicos permanecem constantes, sendo tais que c1 = 5 c2. Na situação acima, os líquidos 1 e 2 sofrem, respectivamente, variações de temperatura ∆T1 e ∆T2, tais que ∆T2 é iguai a:
- A) 5T1.
- B) 2 T2/5.FAZER COMENTÁRIO
- C) T2.
- D) 5T2/2.
- E) 5T2.
A alternativa correta é letra A
Sabendo que a Quantidade de Calor Q é o produto da massa m do corpo pelo seu calor específico c e variação de temperatura , podemos escrever os calores dos corpos 1 e 2:Q1=m1.c1.1Q2=m2.c2.2Pelo enunciado :m1=m2=mQ1=Q2=Qc1=5c2Portanto, temos o sistema,Q=m.5c2.1Q=m.c2.2Resolvendo o sistema acima, obtemos que :1 Alternativa A.58) As pontes de hidrogênio entre moléculas de água são mais fracas que a ligação covalente entre o átomo de oxigênio e os átomos de hidrogênio. No entanto, o número de ligações de hidrogênio é tão grande (bilhões de moléculas em uma única gota de águ
- A) que estas exercem grande influência sobre as propriedades da água, como, por exemplo, os altos valores do calor específico, do calor de vaporização e de solidificação da água. Os altos valores do calor específico e do calor de vaporização da água são fundamentais no processo de regulação de temperatura do corpo humano. O corpo humano dissipa energia, sob atividade normal por meio do metabolismo, equivalente a uma lâmpada de 100 W. Se em uma pessoa de massa 60 kg todos os mecanismos de regulação de temperatura parassem de funcionar, haveria um aumento de temperatura de seu corpo. Supondo que todo o corpo é feito de água, em quanto tempo, aproximadamente, essa pessoa teria a temperatura de seu corpo elevada em 5 ºC?Dado: calor específico da água ≅ 4,2 x 103 J/kg·ºC. FAZER COMENTÁRIO
A alternativa correta é letra C
A quantidade de calor necessária para que haja o aquecimento da água no corpo de uma pessoa de massa 60 kg é dada por:
Sabe-se que a potência dissipada no aquecimento da água no corpo é equivalente a 100 W, tem-se que:
Como 1h equivale a 3600 s,
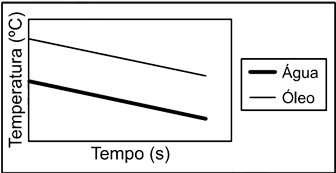
alternativa "C".59) Dentre os 5 gráficos a seguir, assinale aquele que melhor representa o aquecimento de massas iguais de água e óleo, para o experimento realizado:
- A)
- B)
- C)
- D)
 FAZER COMENTÁRIO
FAZER COMENTÁRIO- E)
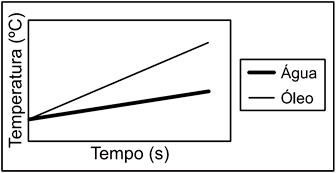
A alternativa correta é letra E
O óleo possui uma curva característica Temperatura X tempo com maiores taxas de variação em relação a água, devido as suas propriedades termodinâmicas . Para uma mesma temperatura inicial isso é evidenciado apenas no gráfico da alternativa E.Continua após a publicidade..60) Se o aquecimento fosse prolongado até 6 min, mantidas as mesmas tendências de variação, as temperaturas aproximadas para 200g de água e 200g de óleo seriam, respectivamente,
- A) 54°C e 126°C
- B) 72°C e 126°C
- C) 72°C e 144°C
FAZER COMENTÁRIO- D) 54°C e 144°C
- E) 72°C e 162°C
« Anterior 1 … 4 5 6 7 8 … 14 Próximo »A alternativa correta é letra C
A tabela nos diz que a água para cada 30s em média varia de 5 em 5º C. Já o óleo no mesmo tempo apresenta uma taxa de variação de 12 em 12º C, em média. Com uma boa aproximação podemos dizer que para 360s (6 min) a água estará em torno de 75º C e o óleo em torno de 140ºC. Portanto, a alternativa que mais se aproxima desses valores é a letra C.
- B)
- A)
- B) 100 mil.
- B) 12 g
- B) 90.
- B) 300.
- B) 120 kg.
