Questões Sobre Gases - Física - 2º ano do ensino médio
1) (OSEC-SP) Volumes iguais de gases nas mesmas condições de temperatura e pressão:
- A) possuem o mesmo potencial de ionização.
- B) possuem a mesma densidade.
- C) possuem a mesma massa.
- D) contém o mesmo número de moléculas.
- E) nenhuma resposta é correta.
A resposta correta é letra D) contém o mesmo número de moléculas.
Volumes iguais, de quaisquer gases, nas mesmas condições de pressão e temperatura, apresentam a mesma quantidade de substâncias em mol (moléculas)
2) (FUMEC 94) Uma determinada massa de um gás ideal sofre uma transformação isotérmica. Se a pressão final for o dobro da inicial, pode-se afirmar que:
- A) todas as alternativas estão erradas
- B) o volume permaneceu constante
- C) a temperatura final é igual a duas vezes a temperatura inicial
- D) o volume final é igual a duas vezes o volume inicial
- E) o volume foi reduzido à metade
A resposta correta é letra E) o volume foi reduzido à metade
Transformação isotérmica (T constante):
P1.V1 = P2.V2
Como a pressão final foi o dobro da inicial:
P1.V1 = 2.P1.V2
V2 = V1/2
O volume final foi reduzido à metade.
3) (UCMG) – O volume ocupado por 2,0 mols de moléculas de um gás ideal à pressão de 2,0.10⁵ N/m² e a 27 ºC é, em m³:
- A) 4,4.10⁻³
- B) 2,2.10⁻³
- C) 2,5.10⁻²
- D) 2,2.10¹
- E) 2,5.10⁻⁸
A resposta correta é letra C) 2,5.10⁻⁸
T = 27 °C —-> 300 K
P.V = n.R.T
2.10⁵ .V = 2.8,31.300
2.10⁵.V = 4986
V = 4986/2.10⁵
V = 2,493 .10⁻² m³
Questão 4
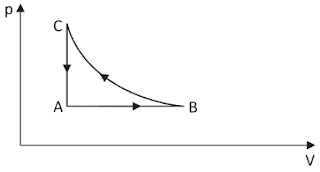

A respeito dessas transformações, afirmou-se o seguinte:
I. O trabalho total realizado no ciclo ABCA é nulo.
II. A energia interna do gás no estado C é maior que no estado A.
III. Durante a transformação A→B, o gás recebe calor e realiza trabalho.
Está correto apenas o que se afirma em
- A) I.
- B) II.
- C) III.
- D) I e II.
- E) II e III.
A alternativa correta é letra E) II e III.
Afirmação I: incorreta. Quando o ciclo está orientado no sentido anti-horário, o trabalho recebido é maior que o realizado, o que indica que o sistema recebe trabalho: portanto, T < 0 (trabalho negativo).
Afirmação II: correta. A energia interna do gás é dada por U = k.P.V. Como PC.VC > PA.PA (ver gráfico), conclui-se que UC > UA.
Afirmação III: correta. Em A→B a pressão se mantém constante e ocorre um aumento de volume, o que indica realização de trabalho. Ademais, se o volume aumenta à pressão constante, a temperatura também aumenta, ou seja, o gás recebeu calor.
Questão 5
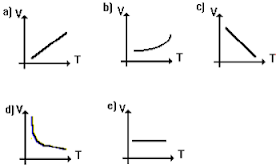
A alternativa correta é letra A)
Na transformação isobárica dos gases, a pressão permanece constante e o volume aumenta ou diminui proporcionalmente à variação da temperatura. O gráfico que representa essa transformação é o da letra A.
6) (FCMMG) – Oxigênio foi introduzido em um botijão durante o inverno europeu a 0 °C e enviado ao Brasil para ser usado num hospital, cuja temperatura média é de 30 °C. Na nova situação, é CORRETO afirmar que
- A) o oxigênio sofreu uma transformação isobárica.
- B) a pressão do oxigênio dentro do botijão não se alterou.
- C) o número de moléculas de oxigênio dentro do botijão aumentou.
- D) o número de colisões das moléculas de oxigênio contra as paredes do botijão aumentou.
A alternativa correta é letra D) o número de colisões das moléculas de oxigênio contra as paredes do botijão aumentou.
- Alternativa a: incorreta. Ao receber calor, o sistema tende a expandir-se, mas é impedido pelas paredes do botijão, portanto a pressão e a temperatura do sistema aumentam. Como não houve alteração no volume, trata-se de uma transformação isovolumétrica.
- Alternativa b: incorreta.
- Alternativa c: incorreta.
- Alternativa d: correta. Um aumento na temperatura provoca um aumento na energia cinética média das moléculas e, com isso, um aumento no número de colisões entre as moléculas de oxigênio.
Questão 7

- 01) O produto da pressão do ar pelo volume que ele ocupa é igual nas duas situações de equilíbrio.
- 02) Na situação representada pela figura da direita, existe menos massa de gelo que na situação representada pela figura da esquerda.
- 04) A partir da situação representada pela figura da esquerda, até a situação representada pela figura da direita, a transformação sofrida pelo ar pode ser compreendida por dois processos termodinâmicos, o primeiro adiabático e o segundo isobárico.
- 08) A partir da situação representada pela figura da esquerda até a situação representada pela figura da direita, a temperatura do ar permaneceu sempre constante.
- 16) Não haverá troca de calor entre o cilindro e a água, mesmo depois de jogar o tijolo e esperar atingir o novo equilíbrio.
Resposta correta: 07 (01 + 02 + 04).
Resolução:
Afirmativa 01: correta. P1.V1 = P2.V2.
Afirmativa 02: correta. Após o êmbolo ser comprimido (como acontece na figura da direita), o ar sofre sofre aquecimento e perde calor para o meio externo (água e gelo). Dessa forma, o gelo esquenta e atinge seu ponto de fusão, virando líquido.
Afirmativa 04: correta. Primeiramente acontece um processo adiabático, pois a compressão é tão rápida que não permite a troca de calor entre o sistema e o meio. A seguir, o gás começa a perder calor para o meio externo, sob pressão constante (isobárico), que é a pressão exercida pela força de compressão que o tijolo provoca no êmbolo.
Afirmativa 08: incorreta. Não permaneceu.
Afirmativa 16: incorreta. Haverá sim troca de calor.
8) (UFMG) – Um mergulhador, na superfície de um lago onde a pressão é de 1,0 atm, enche um balão com ar e então desce a 10 m de profundidade. Ao chegar nessa profundidade, ele mede o volume do balão e vê que este foi reduzido a menos da metade. Considere que, dentro da água, uma variação de 10 m na profundidade produz uma variação de 1 atm de pressão. Se TS é a temperatura na superfície e TP a temperatura a 10 m de profundidade, pode-se afirmar que
- A) TS < TP.
- B) TS = TP.
- C) TS > TP.
- D) não é possível fazer comparação entre as duas temperaturas com os dados fornecidos.
A alternativa correta é letra C) TS > TP.
Se na superfície do lago a pressão é de 1 atm e a cada 10 m de profundidade se produz uma variação de 1 atm na pressão, então a pressão nessa profundidade é de 2 atm.
Superfície:
P.V = TS
1.x = TS
x = TS
Profundidade:
P.V = TP
Como o volume diminuiu mais do que a metade, vamos usar um valor qualquer menor do que x/2, por exemplo x/4.
2.(x/4) = TP
x/2 = TP
Portanto:
TS > TP
9) (PUC Minas–2009) – Um balão de aniversário, cheio de gás hélio, solta-se da mão de uma criança, subindo até grandes altitudes.
- A) O volume do balão diminui.
- B) A pressão do gás no interior do balão aumenta.
- C) O volume do balão aumenta.
- D) O volume do balão permanece constante.
A alternativa correta é letra C) O volume do balão aumenta.
P.V = n.R.T
Considerando que a temperatura se mantenha constante, como há diminuição de pressão externa agindo sobre o balão devido ao ar rarefeito em grandes atitudes, o volume aumenta proporcionalmente á diminuição de pressão.
Questão 10
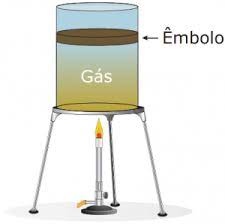
- A) p/V = constante.
- B) p/T = constante.
- C) V/T = constante.
- D) pV = constante.
A alternativa correta é letra C) V/T = constante.
Como o êmbolo é livre para se mover verticalmente, conclui-se que a pressão é constante. A partir da fórmula da equação de estado do gás ideal, temos:
P.V = n.R.T
V = n.R.T/P
V/T = n.R/P
V/T = constante!
