Questões Sobre Cinética Química - Química - 2º ano do ensino médio
Questão 1
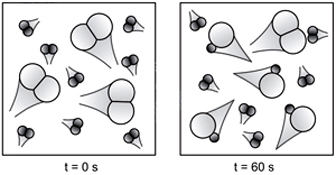
Assinale a alternativa cujo gráfico melhor descreve a cinética da reação.
- A)
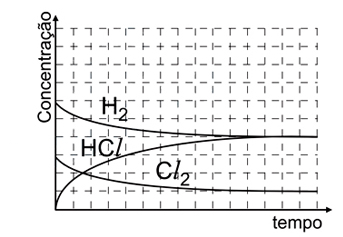
- B)
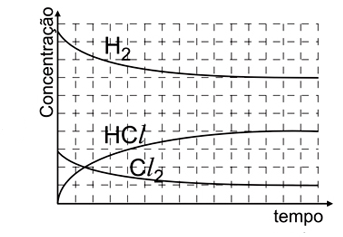
- C)
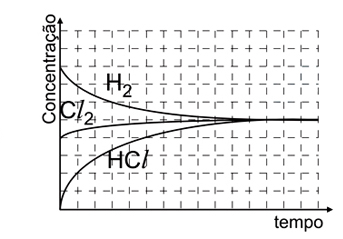
- D)
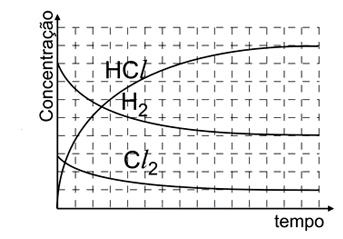
- E)
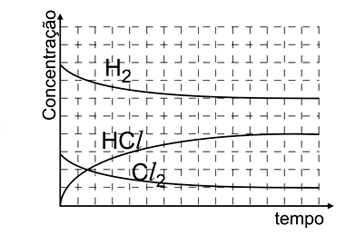 FAZER COMENTÁRIO
FAZER COMENTÁRIOA alternativa correta é letra E
Analisando as figuras, temos que para t = 0s, só existem moléculas de H2 e Cl2, não havendo moléculas de HCl. Além disso, deve-se saber que a molécula menor representa o H2 e a maior o Cl2, nota-se, então, que o H2 está presente em maior quantidade. Observando a figura para t = 60s, nota-se que a quantidade de HCl é maior que a de Cl2, mas menor que a de H2. O gráfico que melhor representa todas essas relações é o E.2) Considere as seguintes afirmações:
- A) I, apenas.
- B) I e II, apenas.
- C) I e III, apenas.
- D) II e III, apenas.
FAZER COMENTÁRIO- E) I, II e III
A alternativa correta é letra B
Analisando a Tabela 1, pode-se julgar cada um dos itens, como mostrado abaixo:Item I: Na tabela, as condições anaeróbicas e com maiores concentrações de Fe2+ e S2–correspondem às maiores profundidades. Assim, é mais provável que os micro-organismos estejam presentes em amostras retiradas de profundidades maiores, ou seja, amostras retiradas a 20 cm terão mais micro-organismos do que a retirada a 5 cm. Portanto, o item está CORRETO.Item II: Realizando a somas dos dois íons citados, observa-se que a soma é bem próxima, portanto, o item está CORRETO.Item III: Analisando o pH na Tabela 1, nota-se que ele cai um velor de 0,5 a cada 5 cm de profundidade, assim, mantendo esta tendência, o pH a 35 cm de profundidade será de 3,5, e não a 30 cm. Portanto, o item está INCORRETO.Assim, a resposta correta é a alternativa B.3) Ao abastecer um automóvel com gasolina, é possível sentir o odor do combustível a certa distância da bomba. Isso significa que, no ar, existem moléculas dos componentes da gasolina, que são percebidas pelo olfato. Mesmo havendo, no ar, moléculas de combustível e de oxigênio, não há combustão nesse caso. Três explicações diferentes foram propostas para isso: I. As moléculas dos componentes da gasolina e as do oxigênio estão em equilíbrio químico e, por isso, não reagem. II. À temperatura ambiente, as moléculas dos componentes da gasolina e as do oxigênio não têm energia suficiente para iniciar a combustão. III. As moléculas dos componentes da gasolina e as do oxigênio encontram-se tão separadas que não há colisão entre elas.
FAZER COMENTÁRIO- A) I.
- B) II.
- C) III.
- D) I e II.
- E) II e III.
A alternativa correta é letra B
Sendo a gasolina um derivado volátil do petróleo - fato que é consequência de uma elevada pressão de vapor - esta dispersa-se no ar. Assim, mesmo a certa distância podemos, pelo olfato, sentir sua presença.Uma vez no ar, as partículas gasosas de gasolina entram em contato com o oxigênio (O2) atmosférico mas não reagem, pois não estão em equilíbrio. O equilíbrio somente é atingido quando a velocidade da reação direta (combustão da gasolina) se iguala a velocidade da reação inversa (regeneração dos reagentes). Assim, a primeira afirmação (I) pode ser descartada. No ar, a temperatura ambiente, mesmo que colidam, as partículas gasosas de gasolina (combustível) e oxigênio (comburente) não são passíveis reação, pois não possuem energia suficiente para reagir. Esta energia, chamada energia de ativação, que normalmente apresenta-se na forma de calor, é a energia necessária para que a reação seja iniciada. Deste modo, conclui-se que a segunda afirmação (II) está correta.Por fim, uma vez dispersas no ar, as partículas de gasolina podem colidir com moléculas de oxigênio, o que descarta a terceira afirmação.Logo, a alternativa que nos remete a apenas uma afirmação correta (segunda afirmação) é a correta, ou seja, alternativa "B".Questão 4
Em determinado processo industrial, ocorre uma transformação química, que pode ser representada pela equação genéricaxA(g) + yB(g) ⇔ zC(g)em que x, y e z são, respectivamente, os coeficientes estequiométricos das substâncias A, B e C.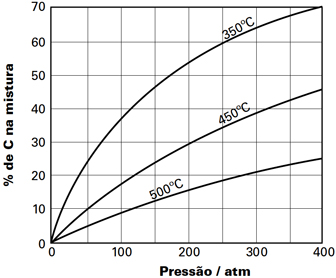 O gráfico representa a porcentagem, em mols, de C na mistura, sob várias condições de pressão e temperatura.Com base nesses dados, pode-se afirmar que essa reação é
O gráfico representa a porcentagem, em mols, de C na mistura, sob várias condições de pressão e temperatura.Com base nesses dados, pode-se afirmar que essa reação é- A) exotérmica, sendo x + y = z
- B) endotérmica, sendo x + y < z
- C) exotérmica, sendo x + y > z
- D) endotérmica, sendo x + y = z
FAZER COMENTÁRIO- E) endotérmica, sendo x + y > z
A alternativa correta é letra C
Analisando o gráfico, à uma pressão constante, por exemplo a 300 atm, observa-se que, quanto menor a temperatura maior é a a porcentagem de carbono na mistura. Dessa forma, é possível concluir que a reação direta é exotérmica, libera calor.Tomando como refererência uma dada temperatura, como, por exemplo 450°C, observa-se que à medida que a pressão aumenta a porcentagem de carbono na mistura, também aumenta. Portanto, o número de mols de C(z) é menor do que a soma dos números de mol de A(x) e B(y), uma vez que à temperatura constante, um aumento na pressão desloca o equilíbrio da reação para o lado de menor número de mols, de menor volume. Assim, x + y > z.Questão 5
O hipoclorito de sódio (NaClO) é muito usado na formulação de desinfetantes. Em condições experimentais adequadas, soluções aquosas dessa substância se decompõem com certa facilidade, mediante formação de oxigênio. Com o intuito de avaliar o efeito da temperatura e da concentração do reagente na velocidade da reação de decomposição química, foram realizados 4 experimentos com soluções de hipoclorito de sódio. O gráfico a seguir mostra o volume de oxigênio coletado no processo de decomposição do NaClO, em função do tempo, para cada um dos experimentos.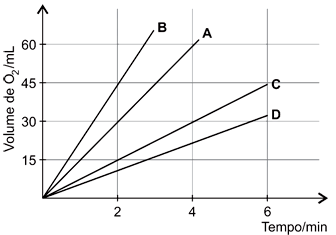 Experimento A: Solução de NaClO 5,0%, T = 25°CExperimento B: Solução de NaClO 5,0%, T = 35°CExperimento C: Solução de NaClO 5,0%, T = 15°CExperimento D: Solução de NaClO 2,5%, T = 25°CDe acordo com os resultados mostrados no gráfico, pode-se afirmar que
Experimento A: Solução de NaClO 5,0%, T = 25°CExperimento B: Solução de NaClO 5,0%, T = 35°CExperimento C: Solução de NaClO 5,0%, T = 15°CExperimento D: Solução de NaClO 2,5%, T = 25°CDe acordo com os resultados mostrados no gráfico, pode-se afirmar que- A) a temperatura não afeta a velocidade da reação.
- B) a velocidade da reação é triplicada ao se variar a temperatura de 15 para 35°C.
- C) a velocidade da reação no experimento A é de aproximadamente 5 mL de O2/ minuto.
- D) a concentração de hipoclorito de sódio não exerce influência na velocidade da reação.
FAZER COMENTÁRIO- E) a quantidade de oxigênio produzida no experimento C, após 4 minutos, será de 15 mL.
A alternativa correta é letra B
Alternativa a - Incorreta, pois observando os 2 minutos iniciais nos experimentos A, B e C onde a concentração não é alterada e a temperatura muda, tem-se que em C (15ºC) em A (25°C) e em B (35°C) o volume de O2 obtido é 15mL para C, 30mL para A e 45mL para B.Alternativa b - Correta, pois ao se variar de 15ºC para 35°C, como a concentração de NaClO é a mesma, tem-se que o volume de O2 obtido é 15mL para 15°C e para 35°C é 45mL, como o volume produzido triplicou pode-se afirmar que a velocidade também é triplicada.Alternativa c - Incorreta, em dois minutos de reação são produzidos 30mL de O2, então tem-se que em A a velocidade é de 15mL de O2/minuto.Alternativa d - Incorreta, pois analisando os experimentos A e D, como a temperatura é a mesma e a concentração de D é metade da de A, tem-se que o volume de O2 produzido em A em 4 minutos é 60mL, enquanto que em D é menor e interpolando no gráfico é aproximadamente 23mL.Alternativa e - Incorreta, pois de acordo com o gráfico o volume de O2 produzido em C após 4 minutos é de 30mL.6) O enxofre é usado na indústria para produzir ácido sulfúrico e para vulcanizar a borracha. A obtenção de enxofre a partir de H2S(g) e SO2(g) requer o uso do catalisador Al2O3(s), conforme a reação
- A) Na ausência do Al2O3(s), a energia de ativação é baixa; por isso, a reação é lenta.
- B) Trata-se de catálise heterogênea, pois o catalisador e os reagentes estão em fases distintas, formando um sistema heterogêneo.
- C) O Al2O3(s) é consumido, pois se trata de catálise heterogênea.
- D) Trata-se de catálise homogênea, pois o H2S e o SO2 estão em fase gasosa, formando um sistema homogêneo.
FAZER COMENTÁRIO- E) O Al2O3(s) participa da reação, mas não é consumido nessa catálise homogênea.
A alternativa correta é letra B
De acordo com o enunciado da questão, o Al2O3(s) atua como catalisador da reação entre os reagentes H2S(g) e SO2(g). A utilização de um catalisador em fase diferente dos reagentes caracteriza a catálise heterogênea. Neste tipo de reação, os catalizadores proporcionam sua superfície para que possa ocorrer a reação, sem que o mesmo seja consumido.Como na reação citada os reagentes (gasosos) estão em fase diferente do catalisador (sólido), pode-se concluir que se trata de um sistema heterogêneo em que ocorre uma reação de catálise heterogênea.Alternativa correta, B.7) Como se observa na tabela, a tendência de variação das
- A) Aumento gradativo nas concentrações de SO42– e Fe3+.
- B) Aumento gradativo nas concentrações de Fe2+ e Fe3+.
- C) Aumento gradativo nas concentrações de SO42– e S2–.
- D) Diminuição gradativa nas concentrações de SO2–4 e Fe3+.
FAZER COMENTÁRIO- E) Não haveria mudança na concentração das quatro espécies citadas.
A alternativa correta é letra A
Analisando os dados fornecidos, pode-se dizer que quando o O2 for borbulhado a sua concentração aumentará, obviamente. Isso acarretará um aumento no pH do meio, e consequentemente, o S2- será oxidado a SO42- e o Fe2+ se oxidadará, liberando íons Fe3+ na solução. Assim, ocorrerá um aumento nas concentrações destes últimos íons (SO42- e Fe3+). Portanto, a resposta correta é a alterativa A.8) Quando cozinhamos os alimentos, o aquecimento acelera os processos que degradam as membranas celulares e as biomoléculas, por exemplo, as proteínas. O efeito da temperatura na velocidade da reação química foi identificado por Svante Arrhenius no final do século XIX pela equação: ln k = ln A – (Ea/RT) Da equação acima, é correto afirmar que
- A) o parâmetro A é a constante de velocidade da reação.
- B) k é o fator pré-exponencial e depende do valor da temperatura.
- C) k e A são fator pré-exponencial e energia de ativação, respectivamente.
- D) k e Ea independem da reação que está sendo estudada.
FAZER COMENTÁRIO- E) A e Ea são basicamente independentes da temperatura.
A alternativa correta é letra E
Considerando a equação dada na questão,ln k = ln A – (Ea/RT)podemos perceber que as variáveis independentes são:A - fator pré-exponencial;Ea - energia de ativação, ou seja, a energia necessária para iniciar uma transformação química.9) Para uma reação elementar do tipo: A + 2B → C, pode-se afirmar que:
- A) a velocidade de consumo de B é a metade da velocidade de formação de C.
- B) a velocidade de consumo de A é igual à velocidade de formação de C.
- C) a soma das velocidades de consumo de A e de B é igual à velocidade de formação de C.
- D) a velocidade da reação é dada por: V = K . [A] . [B].
FAZER COMENTÁRIO- E) a reação é de segunda ordem.
A alternativa correta é letra B
A velocidade individual de cada componente em uma reação mantém a mesma proporção que os seus respectivos coeficientes estequiométricos. Assim, na reação mostrada, tem-se que a velocidade de formação de C é numericamente igual a de consumo de A e metade da de B.Portanto, a resposta correta é a alternativa B.Continua após a publicidade..10) Como se observa na tabela, a tendência de variação das concentrações de S2– e Fe2+ é oposta à das concentrações de SO2-4 e Fe3+, em função da profundidade e, ao mesmo tempo, a concentração dessas quatro espécies químicas é dependente da concentração de O2 disponível. O que seria esperado se O2 fosse borbulhado em uma amostra de sedimento coletada a 20 cm?
- A) Aumento gradativo nas concentrações de SO2–4 e Fe3+
- B) Aumento gradativo nas concentrações de Fe2+ e Fe3+
- C) Aumento gradativo nas concentrações de SO2–4 e S2–
- D) Diminuição gradativa nas concentrações de SO2–4 e Fe3+
FAZER COMENTÁRIO- E) Não haveria mudança na concentração das quatro espécies citadas.
1 2 3 … 7 Próximo »A alternativa correta é letra A
Analisando os dados fornecidos, pode-se dizer que quando o O2 for borbulhado sua concentração aumentará. Isso acarretará um aumento no pH do meio e, consequentemente, o S2– será oxidado a SO42– e o Fe2+ se oxidará, liberando íons Fe3+ na solução. Assim, ocorrerá um aumento nas concentrações destes últimos íons (SO42– e Fe3+). Portanto, a resposta correta é a alternativa A. - B) Aumento gradativo nas concentrações de Fe2+ e Fe3+
- B) a velocidade de consumo de A é igual à velocidade de formação de C.
- B) k é o fator pré-exponencial e depende do valor da temperatura.
- B) Aumento gradativo nas concentrações de Fe2+ e Fe3+.
- B) Trata-se de catálise heterogênea, pois o catalisador e os reagentes estão em fases distintas, formando um sistema heterogêneo.
- B) a velocidade da reação é triplicada ao se variar a temperatura de 15 para 35°C.
- B) endotérmica, sendo x + y < z
- B) I e II, apenas.
- A) I, apenas.
