Continua após a publicidade..
A água oxigenada consiste em uma solução aquosa de peróxido de hidrogênio, que se decompõe, sob a ação da luz e do calor, segundo a equação química:
2 H2O2 (aq) → 2 H2O (l) + O2 (g)
Em um experimento, foi monitorada a quantidade de peróxido de hidrogênio em três frascos idênticos – A, B e C – de 1 L de água oxigenada, mantidos em diferentes condições de luminosidade e temperatura. Observe os resultados no gráfico:
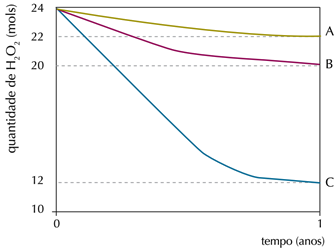
A: ausência de luz (10 °C)
B: ausência de luz (25 °C)
C: presença de luz (25 °C)
B: ausência de luz (25 °C)
C: presença de luz (25 °C)
Na condição em que ocorreu a menor taxa de decomposição do peróxido de hidrogênio, a velocidade média de formação de O2, em mol.ano-1, foi igual a:
2 H2O2 (aq) → 2 H2O (l) + O2 (g)
Em um experimento, foi monitorada a quantidade de peróxido de hidrogênio em três frascos idênticos – A, B e C – de 1 L de água oxigenada, mantidos em diferentes condições de luminosidade e temperatura. Observe os resultados no gráfico:
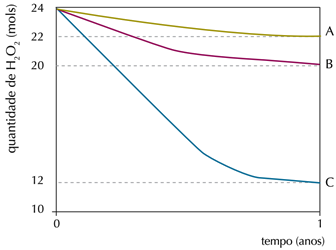
A: ausência de luz (10 °C)
B: ausência de luz (25 °C)
C: presença de luz (25 °C)
B: ausência de luz (25 °C)
C: presença de luz (25 °C)
Na condição em que ocorreu a menor taxa de decomposição do peróxido de hidrogênio, a velocidade média de formação de O2, em mol.ano-1, foi igual a:
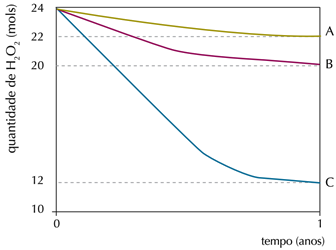
A: ausência de luz (10 °C)
B: ausência de luz (25 °C)
C: presença de luz (25 °C)
B: ausência de luz (25 °C)
C: presença de luz (25 °C)
Na condição em que ocorreu a menor taxa de decomposição do peróxido de hidrogênio, a velocidade média de formação de O2, em mol.ano-1, foi igual a:
- A) 1
- B) 2
- C) 6
- D) 12
Resposta:
A alternativa correta é letra A
A menor taxa de decomposição foi em A, 2 mol.ano-1.
De acordo com a equação, para cada 2 mol de peróxido de hidrogênio (H2O2) que se decompõe forma-se um mol de oxigênio (O2).
Logo, conclui-se que a velocidade media para a formação de O2 foi para 1 mol.ano-1.

Deixe um comentário