Continua após a publicidade..
O hipoclorito de sódio (NaClO) é muito usado na formulação de desinfetantes. Em condições experimentais adequadas, soluções aquosas dessa substância se decompõem com certa facilidade, mediante formação de oxigênio. Com o intuito de avaliar o efeito da temperatura e da concentração do reagente na velocidade da reação de decomposição química, foram realizados 4 experimentos com soluções de hipoclorito de sódio. O gráfico a seguir mostra o volume de oxigênio coletado no processo de decomposição do NaClO, em função do tempo, para cada um dos experimentos.
O hipoclorito de sódio (NaClO) é muito usado na formulação de desinfetantes. Em condições experimentais adequadas, soluções aquosas dessa substância se decompõem com certa facilidade, mediante formação de oxigênio. Com o intuito de avaliar o efeito da temperatura e da concentração do reagente na velocidade da reação de decomposição química, foram realizados 4 experimentos com soluções de hipoclorito de sódio. O gráfico a seguir mostra o volume de oxigênio coletado no processo de decomposição do NaClO, em função do tempo, para cada um dos experimentos.
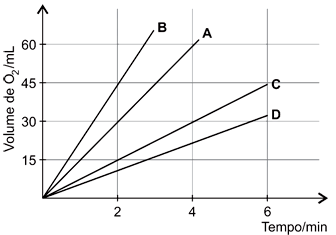
Experimento A: Solução de NaClO 5,0%, T = 25°C
Experimento B: Solução de NaClO 5,0%, T = 35°C
Experimento C: Solução de NaClO 5,0%, T = 15°C
Experimento D: Solução de NaClO 2,5%, T = 25°C
De acordo com os resultados mostrados no gráfico, pode-se afirmar que
- A) a temperatura não afeta a velocidade da reação.
- B) a velocidade da reação é triplicada ao se variar a temperatura de 15 para 35°C.
- C) a velocidade da reação no experimento A é de aproximadamente 5 mL de O2/ minuto.
- D) a concentração de hipoclorito de sódio não exerce influência na velocidade da reação.
- E) a quantidade de oxigênio produzida no experimento C, após 4 minutos, será de 15 mL.
Resposta:
A alternativa correta é letra B
Alternativa a - Incorreta, pois observando os 2 minutos iniciais nos experimentos A, B e C onde a concentração não é alterada e a temperatura muda, tem-se que em C (15ºC) em A (25°C) e em B (35°C) o volume de O2 obtido é 15mL para C, 30mL para A e 45mL para B.
Alternativa b - Correta, pois ao se variar de 15ºC para 35°C, como a concentração de NaClO é a mesma, tem-se que o volume de O2 obtido é 15mL para 15°C e para 35°C é 45mL, como o volume produzido triplicou pode-se afirmar que a velocidade também é triplicada.
Alternativa c - Incorreta, em dois minutos de reação são produzidos 30mL de O2, então tem-se que em A a velocidade é de 15mL de O2/minuto.
Alternativa d - Incorreta, pois analisando os experimentos A e D, como a temperatura é a mesma e a concentração de D é metade da de A, tem-se que o volume de O2 produzido em A em 4 minutos é 60mL, enquanto que em D é menor e interpolando no gráfico é aproximadamente 23mL.
Alternativa e - Incorreta, pois de acordo com o gráfico o volume de O2 produzido em C após 4 minutos é de 30mL.

Deixe um comentário