Questões Sobre Cinética Química - Química - 2º ano do ensino médio
Questão 11
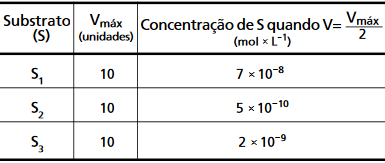
Uma preparação desta enzima foi colocada em três frascos, adicionando-se a cada um deles um substrato diferente: S1, S2 ou S3. Estes substratos são, assim, transformados nos produtos P1, P2 e P3, respectivamente. Considere que:
– a concentração de enzima foi a mesma em todos os frascos;
– a concentração de cada um dos substratos foi mantida constante e igual a 2 x 10-9 mol x L-1, durante o experimento;
– as reações foram realizadas em condições ideais. Ao fim de um minuto de reação, a ordem crescente das quantidades de produtos formados nos três frascos foi:
– a concentração de enzima foi a mesma em todos os frascos;
– a concentração de cada um dos substratos foi mantida constante e igual a 2 x 10-9 mol x L-1, durante o experimento;
– as reações foram realizadas em condições ideais. Ao fim de um minuto de reação, a ordem crescente das quantidades de produtos formados nos três frascos foi:
- A) P1 < P3 < P2
- B) P1 < P2 < P3
- C) P2 < P3 < P1
- D) P3 < P1 < P2
A alternativa correta é letra A
A tabela fornece o valor de Km, ou seja, a concentração do substrato S quando V=Vmáx/2. Quanto menor for o valor de Km, menor será a concentração de S necessária para atingir metade da velocidade máxima. Assim, quanto menor o Km, maior é a afinidade da enzima pelo substrato. Pode-se concluir que S2 é o substrato que possui maior afinidade pela enzima, sendo o que levará à maior quantidade de produto (P2). Usando-se do mesmo raciocínio, em ordem crescente, teremos P1 < P3 < P2. Portanto, a resposta correta é a alternativa A.
12) Glow sticks ou light sticks são pequenos tubos plásticos utilizados em festas por causa da luz que eles emitem. Ao serem pressionados, ocorre uma mistura de peróxido de hidrogênio com um éster orgânico e um corante. Com o tempo, o peróxido e o éster vão reagindo, liberando energia que excita o corante, que está em excesso. O corante excitado, ao voltar para a condição não excitada, emite luz. Quanto maior a quantidade de moléculas excitadas, mais intensa é a luz emitida. Esse processo é contínuo, enquanto o dispositivo funciona. Com base no conhecimento químico, é possível afirmar que o funcionamento do dispositivo, numa temperatura mais baixa, mostrará uma luz
- A) mais intensa e de menor duração que numa temperatura mais alta.
- B) mais intensa e de maior duração que numa temperatura mais alta.
- C) menos intensa e de maior duração que numa temperatura mais alta.
FAZER COMENTÁRIO- D) menos intensa e de menor duração que numa temperatura mais alta.
A alternativa correta é letra C
Quanto maior a temperatura, maior a energia cinética das partículas, maior o número de choques entre as moléculas do peróxido e do éster e, portanto, mais rápida a reação. Desta forma, maior será a intensidade da luz emitida no mesmo intervalo de tempo.Numa temperatura mais baixa, a velocidade da reação será menor, demorará mais tempo para as moléculas reagirem. Logo, teremos uma luz menos intensa e um maior tempo de duração, o que é descrito na alternativa C.Questão 13
Um dos produtos envolvidos no fenômeno da precipitação ácida, gerado pela queima de combustíveis fósseis, envolve o SO2 gasoso. Ele reage com o O2 do ar, numa reação no estado gasoso catalisada por monóxido de nitrogênio, NO. No processo, é gerado SO3, segundo a reação global representada pela equação química balanceada2SO2 + O2 → NO(g) 2SO3No gráfico a seguir estão representadas as variações das concentrações dos componentes da reação em função do tempo de reação, quando a mesma é estudada em condições de laboratório, em recipiente fechado contendo inicialmente uma mistura de SO2, O2 e NO gasosos.No gráfico a seguir estão representadas as variações das concentrações dos componentes da reação em função do tempo de reação, quando a mesma é estudada em condições de laboratório, em recipiente fechado contendo inicialmente uma mistura de SO2, O2 e NO gasosos. As curvas que representam as concentrações de SO2, SO3, O2 e NO são, respectivamente:
As curvas que representam as concentrações de SO2, SO3, O2 e NO são, respectivamente:- A) I, II, III, IV.
- B) II, I, III, IV.
- C) III, I, II, IV.
- D) III, II, I, IV.
FAZER COMENTÁRIO- E) IV, III, II, I.
A alternativa correta é letra C
Sabendo inicialmente que o NO é o catalisador da reação, pode-se dizer que não é consumido, assim, sua concentração é representada pela curva IV.O O2 e o SO2 são reagentes, portanto, no decorrer do tempo têm suas concentrações diminuídas. Pela estequiometria da reação, a concentração de SO2 decresce a níveis menores que a do O2. Assim, a curva do O2 e SO2 são II e III, respectivamente.Como o SO3 é o produto da reação, sua concentração aumenta, representado pela curva I.Sendo assim, se faz correta a alternativa C.14) Deseja-se estudar a influência da concentração dos reagentes sobre a velocidade de uma reação do tipo: A + B → produtos Para isso, foram feitas as seguintes observações: I. duplicando-se a concentração de A, a velocidade da reação também duplicou; II. triplicando-se a concentração de B, a velocidade da reação aumentou por um fator de 9. Assim, se as concentrações de A e de B forem ambas divididas pela metade, a velocidade dessa reação irá
FAZER COMENTÁRIO- A) duplicar.
- B) diminuir pela metade.
- C) aumentar quatro vezes.
- D) diminuir oito vezes.
- E) permanecer a mesma.
A alternativa correta é letra D
A Lei de Velocidade, pode ser descrita pela equação, onde:- v é a velocidade da reação;
- A e B concentração dos reagentes;
- a e b ordem de reação
Para saber o comportamento da velocidade da reação, reduzindo as concentrações de A e B, faz-se necessário interpretar as proposições, onde:I- verifica-se que v é de 1ª ordem em relação à A, ou seja, o índice a é igual a 1.II - verifica-se que v é de 2ª ordem em relação à B, ou seja, o índice b é igual a 2, pois ao triplicar a concentração de B, v aumentou num fator de 9 (32).A partir dessas informações, a equação da velocidade é:(Equação 1)Então, para verificar o que ocorre com a velocidade de reação, caso a concentração de A e B forem divididas pela metade, será considerado:Caso I: [A] = x; [B]=y , onde substituindo na equação 1, tem-se (Equação 2).Caso II: , onde substituindo na equação 1, tem-se: ⇒ .Substituindo a equação 2 em v2, tem-se que , ou seja, se a concentração de A e B forem reduzidas pela metade a velocidade será diminuída 8 vezes. Portanto, alternativa D.Questão 15
 Com relação aos experimentos, pode-se afirmar que
Com relação aos experimentos, pode-se afirmar que- A) os experimentos 5 e 6 apresentam a mesma velocidade de dissolução do mármore porque a superfície de contato de um sólido não afeta a velocidade de uma reação química.
- B) o experimento 1 ocorre mais lentamente que o 2 porque quanto maior for a temperatura, menor será a velocidade de uma reação química.
- C) o experimento 1 ocorre mais rapidamente que o 4 porque a concentração de íons H+ em 1 é maior que no experimento 4.
- D) o experimento 4 ocorre mais lentamente que o 5 porque quanto maior for a temperatura, menor será a probabilidade de ocorrer colisões efetivas entre os íons dos reagentes.
FAZER COMENTÁRIO- E) o experimento 3 ocorre mais lentamente que o 6 porque quanto maior for a concentração dos reagentes, maior será a velocidade de uma reação química.
A alternativa correta é letra C
A questão aborda o conceito de fatores que alteram a velocidade das reações, é necessário saber que os principais fatores que alteram a velocidade são: temperatura, estado de agregação e concentração dos reagentes. Deve-se saber que a velocidade aumenta quanto maior é o contato entre os reagentes, isso ocorre quando há aumento de temperatura, aumento da concentração e quando os reagentes não estão na forma de pedaços maciços. Desse modo, analisando as alternativas,temos:A) INCORRETA, o experimento 5 é mais rápido que o 6, e a superfície de contato afeta a velocidade da reação.B) INCORRETA, o experimento 1 ocorre mais rapido que 2, pois quanto maior a temperatura mais rápida será a reação.C) CORRETA, pois o HCl é um ácido mais forte que o Ácido acético, logo a concentração de H+ é maior em 1.D)INCORRETA, quanto maior a temperatura maior é a possibilidade de ocorrer colisões efetivas entre os íons.E) INCORRETA, o experimento 3 tem velocidade de reação maior que 6.16) A Química Ambiental procura, entre outras coisas, adotar formas de atenuar a emissão de substâncias gasosas que depreciam a qualidade do ar. A reação entre os gases monóxido de carbono e oxigênio para produzir dióxido de carbono, de acordo com a equação abaixo, tem grande importância para o estudo ecológico:
- A) a velocidade de formação do dióxido de carbono independe da concentração dos reagentes;
- B) a velocidade de formação do dióxido de carbono independe da temperatura do ambiente;
- C) a reação química como mostrada acima não está ajustada em sua estequiometria;
- D) a reação é de terceira ordem em relação ao monóxido de carbono;
FAZER COMENTÁRIO- E) a reação é de terceira ordem em relação aos reagentes.
A alternativa correta é letra E
A cinética química é o ramo da Química que estuda as velocidades das reações químicas em diferentes processos, bem como, os fatores que influenciam tais velocidades. Dentre tais fatores que influenciam na velocidade das reações, pode-se citar: a concentração dos reagentes, a temperatura, pressão, entre outros.Com base em tais aspectos, podemos analisar cada uma das alternativas:a) a velocidade de formação do dióxido de carbono independe da concentração dos reagentes - FALSO. O aumento da concentração dos reagentes resultaria no aumento da quantidade de choques efetivos entre os mesmos, causando um aumento da velocidade desta reação. Por outro lado, uma diminuição da concentração dos reagentes resultaria na diminuição da velocidade da reação, devido à menor probabilidade de ocorrência de choques efetivos entre os mesmos. Portanto, a velocidade de formação do CO2(g) é dependente da concentração dos reagentes.b) a velocidade de formação do dióxido de carbono independe da temperatura do ambiente - FALSO. De um modo geral, o aumento da temperatura do sistema deve levar ao aumento da velocidade da reação, devido ao aumento da energia cinética média dos reagentes. Desta forma, os choques seriam mais efetivos e se chegaria ao produtos mais rapidamente.c) a reação química como mostrada acima não está ajustada em sua estequiometria - FALSO. A equação química escrita no enunciado está de acordo com a estequiometria, pois a mesma quantidade de átomos de cada elemento químico aparece antes de depois da seta que indica a ocorrência da reação. Assim, tem-se 2 átomos de carbono antes e 2 depois da reação, bem como, 4 átomos de oxigênio antes e depois da seta.d) a reação é de terceira ordem em relação ao monóxido de carbono - FALSO. A ordem de uma reação química é o parâmetro pelo qual se determina a relação entre a velocidade da reação e a concentração de uma (ou mais) das espécies químicas envolvidas. Para reações elementares, ou seja, aquelas que ocorrem numa única etapa, a estequiometria e a ordem de reação estão relacionadas. Nestes casos, a ordem de reação em relação a uma das espécies químicas envolvidas corresponde ao coeficiente da mesma na equação química balanceada. Portanto, em relação ao monóxido de carbono (CO) a reação é de segunda ordem, uma vez que, o coeficiente estequiométrico desta espécie química é 2.e) a reação é de terceira ordem em relação aos reagentes. VERDADEIRO. Com base na análise do item anterior, pode-se afirmar que para este tipo de reação (reação elementar) a ordem de reação global em relação aos reagentes corresponde à soma dos coeficientes estequiométricos dos reagentes. Logo, esta é uma reação de terceira ordem em relação aos reagentes (2+1=3)17) Considere o enunciado abaixo e as três propostas para completá-lo. A produção de ácido sulfúrico de uma nação é considerada como bom indicador de sua força industrial. O ácido sulfúrico é produzido a partir de enxofre, de oxigênio e de água, por via do processo de contato. Uma das etapas desse processo consiste na oxidação do dióxido de enxofre a trióxido de enxofre, com o uso de oxigênio na presença de pentóxido de vanádio, que atua como catalisador, conforme a equação química abaixo.
- A) Apenas 1.
- B) Apenas 2.
- C) Apenas 3.
- D) Apenas 2 e 3.
FAZER COMENTÁRIO- E) 1, 2 e 3.
A alternativa correta é letra C
Conforme indicado no enunciado, o papel do pentóxido de vanádio nesta reação é de catalisador. Um catalisador é uma espécie química que participa numa reação química, aumentando sua velocidade por diversas formas: diminuição da energia de ativação; diminuição da energia do complexo ativado; modificação do mecanismo da reação. Não há consumo do catalisador ao longo da reação. Com base em tais informações, podemos analisar as proposições: 1, ERRADO. O catalisador atua na cinética da reação, alterando sua velocidade e não o equilíbrio. 2, ERRADO. Novamente, o catalisador não altera o equilíbrio da reação. 3, CORRETO. Uma das formas de o catalisador acelerar uma reação é por fornecer um mecanismo de reação que possibilite menor energia de ativação. Portanto, a alternativa correta é C.18) Para aliviar o mal-estar digestivo, dois irmãos colocaram água do filtro em dois copos. Em um deles, foi colocado um antiácido na forma de comprimido e, no outro, na forma de pó. Apesar de os antiácidos possuírem mesma composição e mesma massa, um deles dissolveu mais rápido que o outro. A diferença no tempo da reação deve-se ao(à)
FAZER COMENTÁRIO- A) catalisador.
- B) temperatura.
- C) concentração.
- D) área de contato.
A alternativa correta é letra D
Resposta D
A superfície de contato entre os reagentes irá determinar a velocidade da reação. O comprimido pulverizado apresenta maior superficie de contato do que o comprimido integro, desta forma um maior número moléculas terão contato imediato com a água permitindo uma dissolução mais rápida.19) Em um experimento, são produzidos feixes de átomos de hidrogênio, de hélio, de prata e de chumbo. Estes átomos deslocam-se paralelamente com velocidades de mesma magnitude.Suas energias cinéticas valem, respectivamente, EH, EHe, EAg e EPb. A relação entre essas energias é dada por:
FAZER COMENTÁRIO- A) EHe > EH > E Pb > EAg
- B) E Ag > EPb > EH > EHe
- C) EH > EHe > E Ag > EPb
- D) EPb > EAg > EHe > EH
A alternativa correta é letra D
Consultando-se a tabela periódica, pode-se estabelecer que as massas dos isótopos do chumbo (Pb), da prata (Ag), do hélio (He) e do hidrogênio (H) obedecem à seguinte relação:mPb > mAg > mHe > mHA energia cinética é diretamente proporcional à massa e ao quadrado do módulo da velocidade. Logo, para corpos com velocidade de mesma magnitude, as energias cinéticas obedecerão à seguinte relação:
EPb > EAg > EHe > EH
Continua após a publicidade..Questão 20
Após uma série de quatro experimentos, o estudante representou os dados obtidos em uma tabela: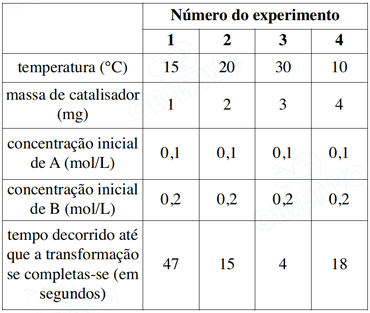 Após uma série de quatro experimentos, o estudante representou os dados obtidos em uma tabela:
Após uma série de quatro experimentos, o estudante representou os dados obtidos em uma tabela: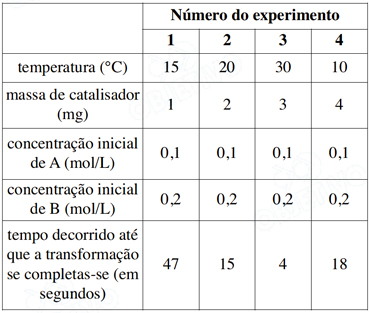 Que modificação deveria ser feita no procedimento para obter resultados experimentais mais adequados ao objetivo proposto?Que modificação deveria ser feita no procedimento para obter resultados experimentais mais adequados ao objetivo proposto?
Que modificação deveria ser feita no procedimento para obter resultados experimentais mais adequados ao objetivo proposto?Que modificação deveria ser feita no procedimento para obter resultados experimentais mais adequados ao objetivo proposto?- A) Manter as amostras à mesma temperatura em todos o experimentos.
- B) Manter iguais os tempos necessários para completar a transformações.
- C) Usar a mesma massa de catalisador em todos o experimentos.
- D) Aumentar a concentração dos reagentes A e B.
FAZER COMENTÁRIO- E) Diminuir a concentração do reagente B.
« Anterior 1 2 3 4 … 7 Próximo »A alternativa correta é letra C
Com a variação da massa do catalisador e da temperatura não consegue-se saber o efeito isolado da variação da temperatura sobre a velocidade da reação para que o estudante possa obter resultados experimentais mais adequados ao objetivo proposto deve-se manter a massa do catalisador constante. - B) Manter iguais os tempos necessários para completar a transformações.
- B) Apenas 2.
- B) a velocidade de formação do dióxido de carbono independe da temperatura do ambiente;
- B) o experimento 1 ocorre mais lentamente que o 2 porque quanto maior for a temperatura, menor será a velocidade de uma reação química.
- B) II, I, III, IV.
- B) mais intensa e de maior duração que numa temperatura mais alta.
