Questões Sobre Cinética Química - Química - 2º ano do ensino médio
21) O alumínio reciclado das latas de refrigerantes é usado para a produção de esculturas. A chuva ácida pode destruir as esculturas de alumínio, pois ele reage em meio ácido conforme a reação a seguir.
- A) A reação é endotérmica, pois a entalpia dos produtos é maior que a dos reagentes.
- B) A velocidade da reação aumenta com o aumento da concentração de ácido sulfúrico, pois a adição desse reagente diminui a energia de ativação da reação.
- C) A temperaturas mais altas, a energia cinética molecular aumenta, por isso as colisões entre as moléculas ocorrem com maior energia, levando a um aumento da velocidade da reação.
- D) A reação é endotérmica, portanto a velocidade da reação aumenta com o aumento da temperatura.
- E) A superfície de contato diminui com a diminuição do tamanho das partículas de alumínio, por isso a velocidade da reação aumenta.
A alternativa correta é letra C
A cinética de uma reação química é o estudo da velocidade e dos fatores que influenciam a velocidade da reação. De acordo com as observações experimentais citadas, pode-se afirmar, primeiramente, que a reação é exotérmica, pois ocorre com liberação de calor. Além disso, percebe-se que a velocidade da reação química do alumínio em meio ácido aumenta de acordo com os seguintes fatores: (1) aumento da concentração dos reagentes; (2) aumento da temperatura; e (3) aumento da superfície de contato do reagente sólido (pela diminuição do tamanho das partículas). Com base em tais afirmações pode-se analisar cada uma das alternativas. A alternativa A é falsa. O fato de a reação liberar calor a classifica exotérmica. A alternativa B é falsa. A adição de um dos reagentes, neste caso o ácido sulfúrico, aumenta o número de colisões efetivas entre as moléculas e isso resulta no aumento da velocidade da reação. A alternativa C está correta. À medida que a temperatura é elevada, o número de choques efetivos para a reação química tende a aumentar, numa reação exotérmica. Isto ocorre devido ao aumento da energia cinética média das moléculas e resulta no aumento da velocidade da reação. A alternativa D é falsa. Conforme já citado, a reação é classificada como exotérmica. E, por fim, a alternativa E também é falsa. A diminuição do tamanho das partículas do reagente sólido, o alumínio, aumenta a sua superfície de contato, pois ao se repartir o sólido uma superfície, que antes era interna, passa a ser externa, aumentando-se o contato deste sólido com os demais reagentes. O resultado é o aumento da velocidade da reação, devido ao maior contato entre os reagentes. Portanto, a resposta correta é a alternativa C.
22) Assinale a alternativa incorreta:
- A) A pulverização de um sólido influi na velocidade de suas reações.
- B) Adicionando um catalisador especifico para a reação, ele aumenta a velocidade dessa reação.
- C) Uma reação química que apresenta energia de ativação extremamente pequena é muito lenta.
- D) Se um reagente é gasoso, a variação de sua pressão influi na velocidade da reação da mesma maneira que a variação de sua concentração.
FAZER COMENTÁRIO- E) A elevação da temperatura aumenta a velocidade da reação química, porque aumenta o número de partículas com energia superior à energia de ativação da reação.
A alternativa correta é letra C
A alternativa incorreta é a letra C. Quanto menor a energia de ativação, menor será a barreira energética a ser rompida para a ocorrência da reação. Portanto, ao se considerar a equação de Arrhenius abaixo, observa-se que velocidade e energia de ativação são inversamente proporcionais.Equação de Arrhenius:V= k.e-Ea/RTOu seja, quanto menor a energia de ativação, maior a tendência da reação em ocorrer mais rapidamente.Questão 23

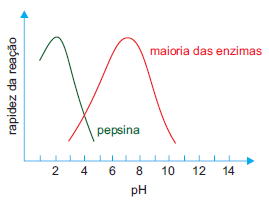 A pepsina é uma enzima presente no suco gástrico, que catalisa a hidrólise de proteínas, como a albumina, constituinte da clara do ovo.
A pepsina é uma enzima presente no suco gástrico, que catalisa a hidrólise de proteínas, como a albumina, constituinte da clara do ovo.
Em um experimento foram utilizados cinco tubos de ensaio contendo quantidades iguais de clara de ovo cozida e quantidades iguais de pepsina. A esses tubos, mantidos em diferentes temperaturas, foram acrescentados iguais volumes de diferentes soluções aquosas.
Assinale a alternativa que indica corretamente qual tubo de ensaio teve a albumina transformada mais rapidamente.FAZER COMENTÁRIO- A)
- B)

- C)

- D)

- E)

A alternativa correta é letra C
A questão expõe dois fatores que estão relacionados à ação enzimática: temperatura e pH. Estes dois são exemplos de ajuste de condições para que seja favorecida a reação.
Interpretando os gráficos, vemos com relação a temperatura que a rapidez da ação da enzima terá sua atividade máxima em 40° C.
Para o pH, vemos que ela atua em pH ácido, ou seja, quanto menor o pH melhor será, visto que sua ação se dá em pH 2.
O pH está relacionado a disponibilidade de íons H+ em solução e por isso podemos descartar as alternativas A e B, pois apresentam soluções básicas que liberariam íons hidroxila, OH-, e consequentemente aumentariam o pH do meio.
Das três alternativas que apresentam o ácido clorídrico, a letra D pode ser descartada por apresentar uma concentração inferior as outras duas apresentadas e assim corresponde a um pH maior, que é 4. Na escala de pH, que vai de 1 a 14, quanto mais próximo de 1 mais ácida é a solução e quanto mais próximo de 14 ela se torna básica, sendo 7 tido como pH neutro. HCl 0,01 mol/l ou 10-2 como tem na alternativa corresponde a pH 2, pois pH = -log (concentração de H+). Nessa formula vemos que quanto maior a concentração de íons H+, menor será o pH.
Temos então que diferenciar as alternativas C e E pelas temperaturas apresentadas. A alternativa E tem temperatura de 60° e pelo gráfico exposto no enunciado vemos que está acima da temperatura de ação da enzima. E por isso, a alternativa correta é a letra C, por possuir a temperatura de 40° C ideal para a atividade catalítica da enzima.Questão 24
 Após realizar esses experimentos, a estudante fez três afirmações:I. A velocidade da reação de Zn com ácido aumenta na presença de Cu.
Após realizar esses experimentos, a estudante fez três afirmações:I. A velocidade da reação de Zn com ácido aumenta na presença de Cu. Após realizar esses experimentos, a estudante fez três afirmações:I. A velocidade da reação de Zn com ácido aumenta na presença de Cu.II. O aumento na concentração inicial do ácido causa o aumento da velocidade de liberação do gás H2.III. Os resultados dos experimentos 1 e 3 mostram que, quanto maior o quociente superfície de contato/massa total de amostra de Zn, maior a velocidade de reação.Com os dados contidos na tabela, a estudante somente poderia concluir o que se afirma em:
Após realizar esses experimentos, a estudante fez três afirmações:I. A velocidade da reação de Zn com ácido aumenta na presença de Cu.II. O aumento na concentração inicial do ácido causa o aumento da velocidade de liberação do gás H2.III. Os resultados dos experimentos 1 e 3 mostram que, quanto maior o quociente superfície de contato/massa total de amostra de Zn, maior a velocidade de reação.Com os dados contidos na tabela, a estudante somente poderia concluir o que se afirma em:- A) I.
- B) II.
- C) I e II.FAZER COMENTÁRIO
- D) I e III.
- E) II e III.
A alternativa correta é letra D
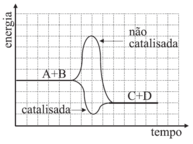
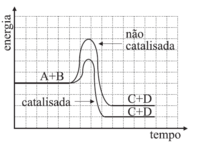
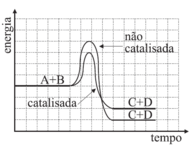
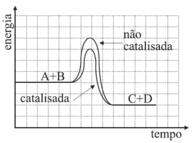
A assertiva I está correta. Pela tabela fornecida, os dados dos experimentos 1 e 4 permitem observar que, para a mesma quantidade de Zn e na mesma forma (raspas), o experimento contendo Cu liberou H2 mais rapidamente. Dessa forma, conclui-se que o Cu atua como um catalisador, aumentando a velocidade da reação. A assertiva II está incorreta. Pela tabela, não houve variação na concentração de ácido nos 4 experimentos. Logo, não se pode concluir que o aumento na sua concentração inicial causa aumento da velocidade de formação de H2. E, por fim, a assertiva III está correta. Os dados dos experimentos I e III mostram que, para uma mesma quantidade de zinco, aquele que está em pó reage mais rapidamente daquele que está em raspas. Isso ocorre porque o Zn em pó apresenta maior superfície de contato, aumentando a velocidade da reação. Estão coerentes as assertivas I e III, portanto, a resposta correta é a alternativa D.25) Os catalisadores desempenham importante papel em vários processos químicos. Uma reação genérica entre os reagentes A e B pode ocorrer na ausência ou na presença de um catalisador (cat).A + B → C + D não-catalisada A + B →cat C + D catalisada
- A)
- B)
- C)
- D)
- E)FAZER COMENTÁRIO

A alternativa correta é letra D
Os catalisadores são utilizados para acelerar a velocidade da reação a partir da diminuição da energia de ativação da reação. O catalisador não tem efeito sobre a composição do equilíbrio de uma reação, ele pode acelerar a velocidade na qual uma reação atinge o equilíbrio, mas ele não afeta a composição no equilíbrio. Sendo assim, ele atua para fornecer uma rota mais rápida para o mesmo destino.Analisando os gráficos, a alternativa em que a concentração dos reagentes e produtos não varia com a adição de catalisador, mas que a energia de ativação diminui com a presença deste, é a D.Questão 26
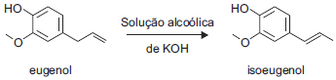 Foram feitos três experimentos de isomerização, à mesma temperatura, empregando-se massas iguais de eugenol e volumes iguais de soluções alcoólicas de KOH de diferentes concentrações. O gráfico a seguir mostra a porcentagem de conversão do eugenol em isoeugenol em função do tempo, para cada experimento.
Foram feitos três experimentos de isomerização, à mesma temperatura, empregando-se massas iguais de eugenol e volumes iguais de soluções alcoólicas de KOH de diferentes concentrações. O gráfico a seguir mostra a porcentagem de conversão do eugenol em isoeugenol em função do tempo, para cada experimento.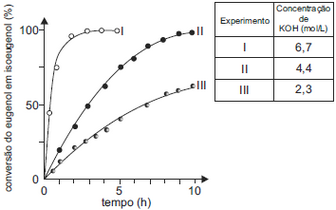 Analisando-se o gráfico, pode-se concluir corretamente queFAZER COMENTÁRIO
Analisando-se o gráfico, pode-se concluir corretamente queFAZER COMENTÁRIO- A) a isomerização de eugenol em isoeugenol é exotérmica.
- B) o aumento da concentração de KOH provoca o aumento da velocidade da reação de isomerização.
- C) o aumento da concentração de KOH provoca a decomposição do isoeugenol.
- D) a massa de isoeugenol na solução, duas horas após o início da reação, era maior do que a de eugenol em dois dos experimentos realizados.
- E) a conversão de eugenol em isoeugenol, três horas após o início da reação, era superior a 50% nos três experimentos.
A alternativa correta é letra B
Basta uma análise do gráfico baseada no conhecimento de Cinética Química. Quanto maior a concentração de KOH, maior a velocidade da transformação.( Observação feita a partir do gráfico fornecido.)27) Analisando-se a equação de obtenção do estireno e considerando-se o princípio de Le Chatelier, é correto afirmar que
FAZER COMENTÁRIO- A) a entalpia da reação aumenta com o emprego do catalisador.
- B) a entalpia da reação diminui com o emprego do catalisador.
- C) o aumento de temperatura favorece a formação de estireno.
- D) o aumento de pressão não interfere na formação de estireno.
- E) o aumento de temperatura não interfere na formação de estireno.
A alternativa correta é letra C
Catalizadores aceleram a produção do produto. O aumento ou a diminuição da pressão e da temperatura ou compostos adicionados a reação podem ser utilizados como catalizadores. Na questão a temperatura pode atuar nessa reação como um catalizador. Ou seja, o aumento da temperatura favorece a formação do produto.
Letra C.28) Ácido clorídrico 1 molar, em excesso, reage mais rapidamente com 1 g de carbonato de cálcio em pó do que com um cristal de carbonato de cálcio de massa igual a 1 g, devido à diferença de:
- A) energia de ativação.
- B) concentração dos reagentes.
- C) produtos da reação.
- D) calor de reação.
FAZER COMENTÁRIO- E) superfície de contato.
A alternativa correta é letra E
Um aspecto que influencia na velocidade da reação é a forma em que os reagentes se encontram. Quão mais triturado um sólido é melhor, pois aumenta a superfície de contato e torna a reação mais rápida. No caso, um cristal possui menos superfície de contato que a mesma massa porém em pó.29) Quando se leva uma esponja de aço à chama de um bico de gás, a velocidade da reação de oxidação é tão grande que incendeia o material. O mesmo não ocorre ao se levar uma lâmina de aço à chama. Nessas experiências, o
- A) a pressão
- B) o catalisador
- C) o estado físico
- D) a concentração
FAZER COMENTÁRIO- E) a superfície de contato
A alternativa correta é letra E
A diferença entre as velocidades de combustão no caso de uma esponja de aço e de uma lâmina está na área superficial da esponja ser muito maior que a da lâmina, assim, há um maior contato entre os reagentes: aço e oxigênio. Até porque, a concentração de aço, pressão e estado físico são iguais.Portanto, a resposta correta é a alternativa E.Continua após a publicidade..Questão 30
 Assinale a afirmativa correta.
Assinale a afirmativa correta.- A) A reação é exotérmica devido ao catalisador empregado.
- B) A entalpia da reação modificou-se devido ao emprego do catalisador.
- C) A energia de ativação da reação diminuiu devido ao emprego do catalisador.
- D) A reação é endotérmica devido ao emprego do catalisador.
FAZER COMENTÁRIO- E) O catalisador não teve efeito algum na energia de ativação da reação.
« Anterior 1 2 3 4 5 … 7 Próximo »A alternativa correta é letra C
A reação é exotérmica, liberando energia. A reação com o emprego do catalisador apresenta uma menor energia de ativação.Portanto, a reposta correta é a alternativa C. - B) A entalpia da reação modificou-se devido ao emprego do catalisador.
- B) o catalisador
- B) concentração dos reagentes.
- B) Adicionando um catalisador especifico para a reação, ele aumenta a velocidade dessa reação.
