Questões Sobre Cinética Química - Química - 2º ano do ensino médio
31) A equação X + 2 Y → XY2 representa uma reação, cuja equação da velocidade é:
- A) 3,0
- B) 0,5
- C) 1,0
- D) 0,75
FAZER COMENTÁRIO- E) 1,5
A alternativa correta é letra E
Sabemos que, na fórmula de velocidade, os termos [X] e [Y] referem-se às concentrações de cada reagente. É sabido também que a concentração de X é de 1M e de Y é 2M e que a velocidade encontrada é de 3 mol/L.min. Para encontrar o valor da constante k, basta substituir esses valores na fórmula:v = k.[X].[Y]k = v/ ([X].[Y])k = 1,5Portanto, a resposta correta é a alternativa E.32) Em determinada experiência, a reação de formação da água (2 H2 + O2 → 2 H2O) está ocorrendo com consumo de 2 mols de oxigênio por minuto. Qual a velocidade média da reação em mols/minutos?
- A) 12
- B) 10
- C) 8
- D) 4
FAZER COMENTÁRIO- E) 2
A alternativa correta é letra E
Sabendo-se que em uma reação química a velocidade média pode ser considerada como a velocidade mais lenta, ou seja, a velocidade de geração ou consumo da substância de menor coeficiente estequiométrico, e que a velocidade de consumo e formação dos outros compostos são proporcionais a mais lenta, pode-se concluir que a velocidade média da reação é igual à velocidade de consumo de O2, ou seja, 2 mols/min.Portanto, a resposta correta é a alternativa E.Questão 33
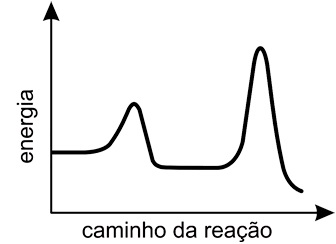
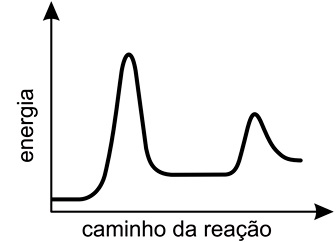
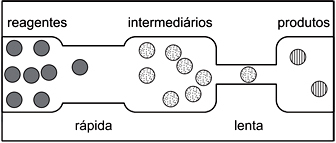 Em seguida, solicitou aos estudantes que traçassem um gráfico da energia em função do caminho da reação, para o sistema representado.Para atender corretamente à solicitação do professor, os estudantes devem apresentar um gráfico como o que está representado em:FAZER COMENTÁRIO
Em seguida, solicitou aos estudantes que traçassem um gráfico da energia em função do caminho da reação, para o sistema representado.Para atender corretamente à solicitação do professor, os estudantes devem apresentar um gráfico como o que está representado em:FAZER COMENTÁRIO- A)
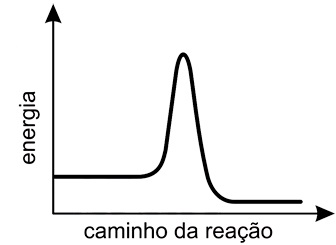
- B)
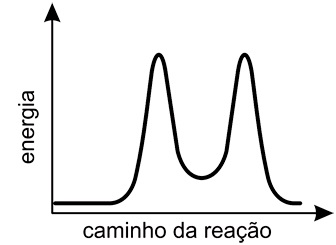
- C)
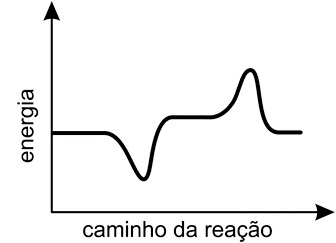
- D)
- E)
A alternativa correta é letra D
Pela figura do enunciado, deve-se observar que a reação ocorre em duas etapas, a etapa rápida e a etapa lenta. A diferença entre essas duas etapas é a velocidade com que elas ocorrem: a etapa rápida é mais veloz pois sua energia de ativação é menor, e a lenta é mais demorada pois requer maior energia de ativação. A energia de ativação pode ser dada como o "pico" dos gráficos de "energia vs caminho da reação", assim, o gráfico esperado deve mostrar primeiro uma etapa rápida (energia de ativação baixa) e depois uma etapa lenta (energia de ativação alta). Portanto, a resposta correta é a alternativa D.Questão 34
NaHCO3(s)+H+X–(s)→H2ONa+(aq)+X–(aq)+CO2(g)+H2O(l)H+X– = ácido orgânico sólidoforam realizados três experimentos, empregando comprimidos de antiácido efervescente, que contêm os dois reagentes no estado sólido. As reações foram iniciadas pela adição de iguais quantidades de água aos comprimidos, e suas velocidades foram estimadas observando-se o desprendimento de gás em cada experimento. O quadro a seguir resume as condições em que cada experimento foi realizado. Assinale a alternativa que apresenta os experimentos em ordem crescente de velocidade de reação.
Assinale a alternativa que apresenta os experimentos em ordem crescente de velocidade de reação.- A) I, II, III.
- B) II, I, III.
- C) III, I, II.
- D) II, III, I.
FAZER COMENTÁRIO- E) III = I, II.
A alternativa correta é letra B
Existem dois fatores que influenciam na velocidade da reação nestes experimentos, a temperatura e a superfície de contato do comprimido, a sua forma de adição.Quanto maior for a temperatura de um sistema, mais rapidamente a reação ocorrerá pois mais moléculas tem energia maior que a energia de ativação.Quanto maior for a superfície de contato entre os reagentes, maior será a velocidade da reação, sendo que a superfície de contato do comprimido é maior quando este está moído.Os experimentos I e III apresentam uma temperatura mais alta (400C), entretanto, no experimento III o comprimido é adicionado moído, de forma que ambos os fatores contribuem para o aumento da velocidade da reação, sendo este o de velocidade maior. Em sequência, temos o experimento I, realizado em temperatura alta, porém, com o comprimido inteiro, com uma velocidade intermediária, e por fim, o experimento II, que apresenta temperatura mais baixa (20ºC) e com o comprimido inteiro.Portanto, temos que a velocidade de reação aumenta em ordem crescente na sequência II < I < III.35) Para a reação 2X + Z → P, verifica-se experimentalmente que a velocidade de formação de P independe da concentração de Z e é quadruplicada quando se dobra a concentração de X. Indique a expressão matemática da lei de velocidade para essa reação.
- A) K . [X]2 . [Z]
- B) K . [X]4 . [Z]
- C) K . [X]6
- D) K . [X]4
FAZER COMENTÁRIO- E) K . [X]2
A alternativa correta é letra E
Desconsiderando a informação do enunciado, baseando-se somente na reação, a velocidade da reação é dada da seguinte forma:v = K.[X]2.[Z]No enunciado, afirma-se que a velocidade independe da concentração de Z e dizer que a velocidade quadruplica quando X é dobrado, significa que a concentração de X está elevada ao quadrado. Com essas observações, chega-se que a velocidade de reação é dada por:v = K.[X]2Portanto, a resposta correta é a alternativa E.Questão 36
2 H2O2 (aq) → 2 H2O (l) + O2 (g)
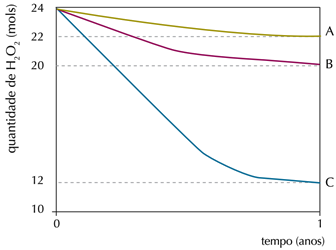
Em um experimento, foi monitorada a quantidade de peróxido de hidrogênio em três frascos idênticos – A, B e C – de 1 L de água oxigenada, mantidos em diferentes condições de luminosidade e temperatura. Observe os resultados no gráfico: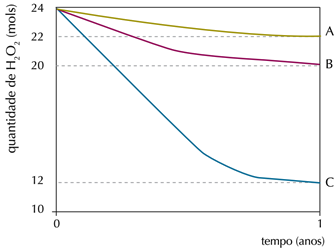 A: ausência de luz (10 °C)
A: ausência de luz (10 °C)
B: ausência de luz (25 °C)
C: presença de luz (25 °C)Na condição em que ocorreu a menor taxa de decomposição do peróxido de hidrogênio, a velocidade média de formação de O2, em mol.ano-1, foi igual a:
2 H2O2 (aq) → 2 H2O (l) + O2 (g)
Em um experimento, foi monitorada a quantidade de peróxido de hidrogênio em três frascos idênticos – A, B e C – de 1 L de água oxigenada, mantidos em diferentes condições de luminosidade e temperatura. Observe os resultados no gráfico: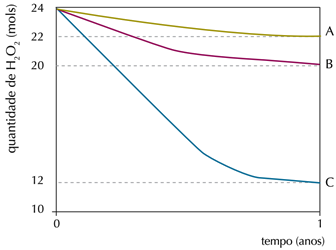 A: ausência de luz (10 °C)
A: ausência de luz (10 °C)
B: ausência de luz (25 °C)
C: presença de luz (25 °C)Na condição em que ocorreu a menor taxa de decomposição do peróxido de hidrogênio, a velocidade média de formação de O2, em mol.ano-1, foi igual a:
 A: ausência de luz (10 °C)
A: ausência de luz (10 °C)
B: ausência de luz (25 °C)
C: presença de luz (25 °C)Na condição em que ocorreu a menor taxa de decomposição do peróxido de hidrogênio, a velocidade média de formação de O2, em mol.ano-1, foi igual a:
- A) 1
- B) 2
FAZER COMENTÁRIO- C) 6
- D) 12
A alternativa correta é letra A
A menor taxa de decomposição foi em A, 2 mol.ano-1.De acordo com a equação, para cada 2 mol de peróxido de hidrogênio (H2O2) que se decompõe forma-se um mol de oxigênio (O2).Logo, conclui-se que a velocidade media para a formação de O2 foi para 1 mol.ano-1.37) Observe a propaganda desse medicamento:
- A) Temperatura.
- B) Catalisador.
- C) Luz.
- D) Estado físico dos reagentes.
FAZER COMENTÁRIO- E) Superfície de contato.
A alternativa correta é letra E
O fator responsável pelo aumento na velocidade de absorção é a superfície de contato, pois a mesma massa de analgésico é dividida em partículas bem menores, o que aumenta a área superficial total, permitindo uma maior taxa absorção do remédio pelo organismo.Portanto, a resposta correta é a alternativa E.Questão 38
 a expressão da lei de velocidade e o valor da constante k
a expressão da lei de velocidade e o valor da constante k
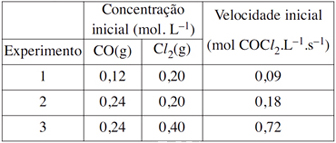
de velocidade para a reação que produz o cloreto de carbonila,
CO(g) + Cl2(g) → COCl2(g), são, respectivamente:FAZER COMENTÁRIO- A) v = k [CO(g)]1 + [Cl2(g)]2, k = 0,56 L2.mol–2.s–1
- B) v = k [CO(g)]2 [Cl2(g)]1, k = 31,3 L2.mol–2.s–1
- C) v = k [Cl2(g)]2 , k = 2,25 L2.mol–2.s–1
- D) v = k [CO(g)]1 [Cl2(g)]2, k = 18,8 L2.mol–2.s–1
- E) v = k [CO(g)]1 [Cl2(g)]1, k = 0,28 L2.mol–2.s–1
A alternativa correta é letra D
A questão trata da ordem da reação em relação aos reagentes. Para a resolução, cada reagente deve ser considerado isoladamente e verificar como a velocidade da reação é alterada quando a concentração deste reagente é modificada.Analisando os experimentos 1 e 2, nota-se que mantendo-se constante a concentração de Cl2 e dobrando-se a concentração de CO, dobra-se também a velocidade da reação, portanto a reação é de primeira ordem em relação ao CO.Analisando os experimentos 2 e 3, nota-se que mantendo-se constante a concentração do CO e dobrando-se a concentração do Cl2, quadruplica-se a velocidade da reação, portanto, a reação é de segunda ordem em relação ao Cl2.Conhecendo as ordens da reação em relação aos reagentes estabelecemos a lei da velocidade.v = k [CO(g)]1 [Cl2(g)]2
Desse modo, é possivel calcular K, por :v = k [CO(g)]1 [Cl2(g)]2 → k = v/[CO(g)]1 [Cl2(g)]2K = (0,09)/(0,12)(0,20)2k = 18,8 L2.mol–2.s–1Portanto, a resposta correta é DQuestão 39
2NO(g) + 2H2(g) → N2(g) + 2H2O(g),a velocidade da reação, em função da pressão de hidrogênio (PH2), para duas diferentes pressões de óxido nítrico (PNO), à temperatura de 826°C, está indicada no seguinte gráfico: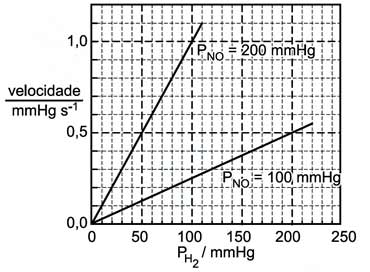
Examinando o gráfico, pode-se concluir que as ordens da reação, em relação ao óxido nítrico e em relação ao hidrogênio, são, respectivamente,- A) 1 e 1.
- B) 1 e 2.
- C) 2 e 1.
- D) 2 e 2.
FAZER COMENTÁRIO- E) 3 e 1.
A alternativa correta é letra C
A questão aborda o tema da ordem de reação. Para resolvê-la, será necessário analisar o gráfico de duas formas:I) Mantendo-se a pressao de H2 constante à 100 mmHg, temos para uma pressão de 100 mmHg de óxido nítrico uma velocidade de aproximadamente 0,25 mmHgs-1, já para a pressão de 200 mmHg de óxido nítrico temos a velocidade em 1,0 mmHgs-1, ou seja dobrando-se a pressão do óxido quadruplica-se a velocidade da reação, logo a reação é de 2a ordem em relação ao NO.II)Agora mantendo-se a pressão de NO constante á 200 mmHg, nota-se que aumentando a pressão de H2 de 50mmHg para 100mmHg há uma variação de velocidade de 0,5 para 1,0 mmHgs-1, ou seja, dobrando-se a pressão de H2, dobra-se também a velocidade da reação, portanto a reação é de 1a ordem em relação ao H2.Continua após a publicidade..Questão 40
As variações da velocidade de reação da hidrólise da sacarose em função do pH do meio estão mostradas em dois dos gráficos abaixo.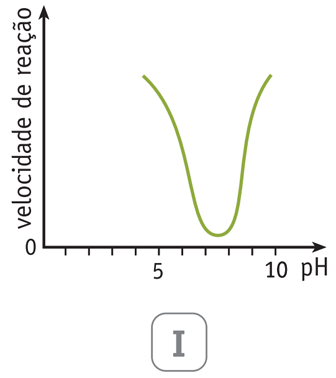
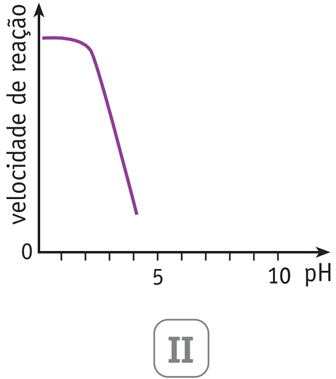
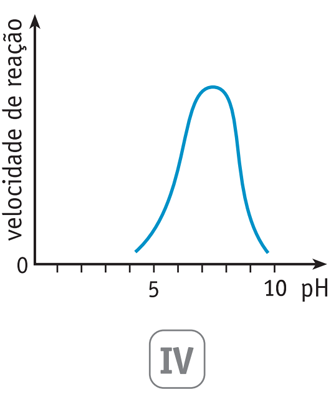 Aqueles que representam a hidrólise catalisada pela enzima e pelo HCl são, respectivamente, os de números:
Aqueles que representam a hidrólise catalisada pela enzima e pelo HCl são, respectivamente, os de números:
- A) I e II
- B) I e III
- C) IV e II
FAZER COMENTÁRIO- D) IV e III
« Anterior 1 2 3 4 5 6 7 Próximo »A alternativa correta é letra C
Sabe-se que a ação da enzima sacarase como catalisador tem máxima efetividade em pH neutro, ou seja, em torno de 7,0. À medida que o pH aumenta ou diminui, esta efetividade sofre redução, diminuindo a velocidade de reação. Isto resulta no gráfico IV, representado pela curva gaussiana, com máximo em pH em torno de 7,0.
No caso da catálise utilizando HCl, a ação deste ácido em pH entre 1,0 - 3,0 proporcionará maiores velocidades de reação. Isto ocorre devido à grande disponibilidade de íons H+ vinda da alta concentração de HCl na solução. Para maiores valores de pH, a velocidade de reação diminui linearmente, pois a concentração de íons H+ em, solução está diminuindo. Por esta razão o gráfico II representa a reação com HCl como catalisador.
Resposta correta: alternativa C. - B) I e III
- B) 1 e 2.
- B) Catalisador.
- B) 2
- B) K . [X]4 . [Z]
- B) II, I, III.
- B) 10
- B) 0,5
