Questões Sobre Cinética Química - Química - 2º ano do ensino médio
41) A formação do dióxido de carbono (CO2) pode ser representada pela equação:
- A) 8
- B) 16
- C) 2
- D) 12
FAZER COMENTÁRIO- E) 4
A alternativa correta é letra E
Analisando a relação estequiométrica da reação, nota-se que a razão dióxido de carbono : oxigênio é igual a 1:1 , dessa forma, se a velocidade de formação de CO2 é de 4 mol/min, a velocidade de consumo de O2 deve ser igual.Portanto, a reposta correta é a alternativa E.42) A primeira série de experimentos, cujos dados são mostrados na tabela 1, permite concluir que
- A) a velocidade da reação não depende da quantidade detiossulfato adicionado.
- B) a velocidade de formação de enxofre depende da concentração de ácido clorídrico.
- C) a quantidade de enxofre formado depende da concentração de tiossulfato.
- D) a formação de enxofre somente ocorre na presença de ácido (HCl).
FAZER COMENTÁRIO- E) o enxofre aparece mais rapidamente em soluções contendo mais tiossulfato.
A alternativa correta é letra E
Observando a Tabela 1, pode-se concluir que com o aumento na concentração de tiossulfato, a velocidade de formação de enxofre aumenta, dessa forma, o tiossulfato tem uma forte influência na velocidade da reação analisada.Portanto, a resposta correta é a alternativa E.43) Seja a reação de decomposição:
- A) a velocidade da reação pode ser calculada pela expressão v=k[N2O5]2.
- B) a velocidade de reação pode ser calculada na forma: v=k[NO2]4[O2].[N2O5]2.
- C) a ordem global da reação é 5.
- D) é uma reação endotérmica, por causa do O2.
FAZER COMENTÁRIO- E) é uma reação exotérmica, por causa do NO2.
A alternativa correta é letra A
Sabendo que a velocidade de reação é determinada pelo produto de uma constante pela concentração inicial dos reagentes elevado ao seu coeficiente estequiométrico, pode-se concluir que a expressão da velocidade de reação é dada por: v = k.[N2O5]2Portanto, a resposta correta é a alternativa A.Questão 44
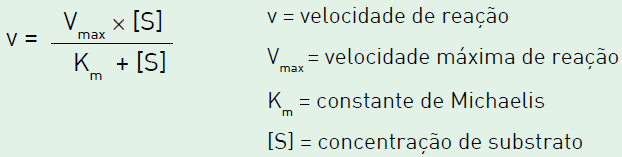 A constante de Michaelis corresponde à concentração de substrato na qual v = Vmax/2. Considere um experimento em que uma enzima, cuja constante de Michaelis é igual a 9 x 10-3 milimol/L, foi incubada em condições ideais, com concentração de substrato igual a 10-3 milimol/L. A velocidade de reação medida correpondeu a 10 unidades. Em seguida, a concentração de substrato foi bastante elevada de modo a manter essa enzima completamente saturada. Neste caso, a velocidade de reação medida será, nas mesmas unidades, equivalente a:FAZER COMENTÁRIO
A constante de Michaelis corresponde à concentração de substrato na qual v = Vmax/2. Considere um experimento em que uma enzima, cuja constante de Michaelis é igual a 9 x 10-3 milimol/L, foi incubada em condições ideais, com concentração de substrato igual a 10-3 milimol/L. A velocidade de reação medida correpondeu a 10 unidades. Em seguida, a concentração de substrato foi bastante elevada de modo a manter essa enzima completamente saturada. Neste caso, a velocidade de reação medida será, nas mesmas unidades, equivalente a:FAZER COMENTÁRIO- A) 1
- B) 10
- C) 100
- D) 1000
A alternativa correta é letra C
Com os dados fornecidos, pode-se determinar o valor da constante Vmáx da equação. Isso é feito da seguinte maneira:Assim, quando a concentração de substrato é máxima, a velocidade máxima de reação que se pode atingir é a Vmáx, ou seja, 100 unidades.Portanto, a resposta correta é a alternativa C.Questão 45
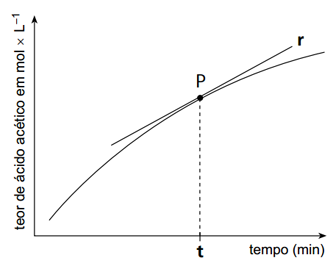 A velocidade da reação de decomposição do acetato de celulose pode ser determinada a partir da equação da reta r, tangente à curva no ponto P, que é definida por y=150t+1, na qual t representa o tempo em minutos. A velocidade dessa reação no instante t, em mol L−1 min−1, e sua classificação estão indicadas em:
A velocidade da reação de decomposição do acetato de celulose pode ser determinada a partir da equação da reta r, tangente à curva no ponto P, que é definida por y=150t+1, na qual t representa o tempo em minutos. A velocidade dessa reação no instante t, em mol L−1 min−1, e sua classificação estão indicadas em:- A) 0,002 − oxidação
- B) 0,002 − esterificação
- C) 0,020 − Hidrólise
FAZER COMENTÁRIO- D) 0,200 − neutralização
A alternativa correta é letra C
A velocidade de reação é dada pelo coeficiente angular da reta tangente à curva de decomposição do acetato de celulose:A reação é classificada por hidrólise, na qual o acetato de celulose reage com moléculas de água presentes na atmosfera. O ânion acetato (CH3CHOO-) possui um elétron desemparelhado que atrai o átomo de hidrogênio presente na molécula de água, formando o ácido acético (CH3CHOOH). Portanto, a alternativa correta é a C.Questão 46
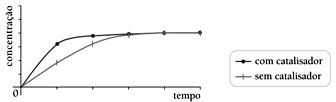
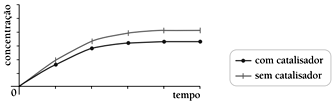
 As curvas de produção de butanoato de etila para as reações realizadas com e sem a utilização do ácido sulfúrico como catalisador estão apresentadas no seguinte gráfico:
As curvas de produção de butanoato de etila para as reações realizadas com e sem a utilização do ácido sulfúrico como catalisador estão apresentadas no seguinte gráfico:- A)
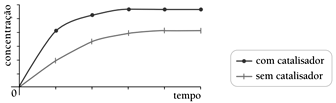
- B)
- C)
- D)
FAZER COMENTÁRIO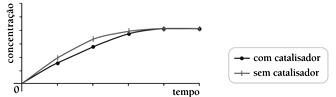
A alternativa correta é letra B
Em relação à velocidade das reações químicas, sabe-se que a presença do catalisador numa reação somente acelera a velocidade desta, de modo que as quantidades obtidas do produto não são alteradas. Ou seja, o catalisador acelera a velocidade de reação de modo a atingir o equilíbrio mais rapidamente. Logo, os gráficos das alternativas A, C e D estão estariam incorretos. O gráfico que melhor representa as estabilizações das curvas com menor tempo para a curva catalisada é representado pela alternativa B. Portanto, a resposta correta é a alternativa B.47) A equação 3X + 2Y → Z representa uma reação química. Sabendo que a constante K é 4, a concentração de X é 2mol/L e que a concentração de Y é 3mol/L, o valor da velocidade da reação, considerando a velocidade da reação em mol/minuto, é de:
- A) 24
- B) 72
- C) 96
- D) 144
FAZER COMENTÁRIO- E) 288
A alternativa correta é letra E
A velocidade de uma reação é dada pela seguinte forma:v= k.[A]a.[B]bPortanto, na reação dada na questão, tem-se:v= k.[X]3.[Y]2v= 4.23.32v= 288A resposta correta é a alternativa E.48) A China, sede das Olimpíadas de 2008, foi o berço de muitas invenções e descobertas de grande impacto para a humanidade, como o papel, a bússola e a pólvora, entre outras. O uso bélico da pólvora implica a adequação da velocidade de sua queima ao tipo de arma a que se destina. Considerando-se a reação química da queima da pólvora, representada pela equação:
FAZER COMENTÁRIO- A) Promover a reação sob atmosfera de N2.
- B) Utilizar pólvora previamente refrigerada.
- C) Utilizar pólvora finamente pulverizada.
- D) Utilizar excesso de carvão.
- E) Usar uma solução supersaturada de pólvora.
A alternativa correta é letra C
Os reagentes da reação de explosão da pólvora são sólidos; logo, a velocidade da reação será diretamente proporcional à temperatura e à superfície de contato entre os reagentes. A velocidade de reações em geral é maior com a elevação da temperatura e o aumento da superfície de contato; portanto, a pólvora deve estar pulverizada e não refrigerada. Logo a alternativa C é correta.Questão 49
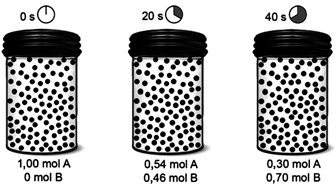 Sobre a velocidade dessa reação, é correto afirmar que a velocidade de:
Sobre a velocidade dessa reação, é correto afirmar que a velocidade de:- A) decomposição da substância A, no intervalo de tempo de 0 a 20 s, é 0,46 mol/s.
- B) decomposição da substância A, no intervalo de tempo de 20 a 40 s, é 0,012 mol/s.
- C) decomposição da substância A, no intervalo de tempo de 0 a 40 s, é 0,035 mol/s.
- D) formação da substância B, no intervalo de tempo de 0 a 20 s, é 0,46 mol/s.
FAZER COMENTÁRIO- E) formação da substância B, no intervalo de tempo de 0 a 40 s, é 0,70 mol/s.
A alternativa correta é letra B
A velocidade de decomposição da substância A é dada pela razão entre a variação molar de A e o tempo gasto.Assim,0 a 20 s :De 20 a 40 s :O sinal negativo indica a decomposição.Portanto, a resposta correta é a alternativa B.Continua após a publicidade..50) Dada a reação: N2 + 3 H2 → 2 NH3. Num dado instante há 0,15 mols de N2 no sistema e após 100 segundos há 0,12 mols de N2. Calcule nesse intervalo de tempo a velocidade de consumo de N2 em mols/s.
- A) 0, 003.
- B) 3 . 10-3.
- C) 3 . 10-4.
- D) 0,03.
FAZER COMENTÁRIO- E) 3.
« Anterior 1 … 3 4 5 6 7 Próximo »A alternativa correta é letra C
A velocidade de consumo de N2 é dada pela seguinte equação:O sinal negativo indica que o N2 foi consumido.Portanto, a resposta correta é a alternativa C. - B) 3 . 10-3.
- B) decomposição da substância A, no intervalo de tempo de 20 a 40 s, é 0,012 mol/s.
- B) 72
- B)
- B) 0,002 − esterificação
- B) a velocidade de reação pode ser calculada na forma: v=k[NO2]4[O2].[N2O5]2.
- B) a velocidade de formação de enxofre depende da concentração de ácido clorídrico.
- B) 16
