Continua após a publicidade..
Para a transformação representada por
2NO(g) + 2H2(g) → N2(g) + 2H2O(g),
a velocidade da reação, em função da pressão de hidrogênio (PH2), para duas diferentes pressões de óxido nítrico (PNO), à temperatura de 826°C, está indicada no seguinte gráfico:
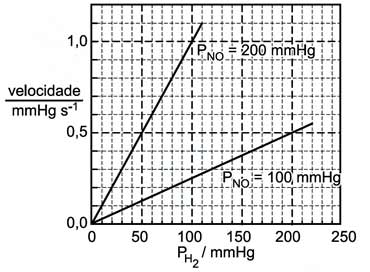
Examinando o gráfico, pode-se concluir que as ordens da reação, em relação ao óxido nítrico e em relação ao hidrogênio, são, respectivamente,
- A) 1 e 1.
- B) 1 e 2.
- C) 2 e 1.
- D) 2 e 2.
- E) 3 e 1.
Resposta:
A alternativa correta é letra C
A questão aborda o tema da ordem de reação. Para resolvê-la, será necessário analisar o gráfico de duas formas:
I) Mantendo-se a pressao de H2 constante à 100 mmHg, temos para uma pressão de 100 mmHg de óxido nítrico uma velocidade de aproximadamente 0,25 mmHgs-1, já para a pressão de 200 mmHg de óxido nítrico temos a velocidade em 1,0 mmHgs-1, ou seja dobrando-se a pressão do óxido quadruplica-se a velocidade da reação, logo a reação é de 2a ordem em relação ao NO.
II)Agora mantendo-se a pressão de NO constante á 200 mmHg, nota-se que aumentando a pressão de H2 de 50mmHg para 100mmHg há uma variação de velocidade de 0,5 para 1,0 mmHgs-1, ou seja, dobrando-se a pressão de H2, dobra-se também a velocidade da reação, portanto a reação é de 1a ordem em relação ao H2.

Deixe um comentário