Questões Sobre Eletroquímica - Química - 2º ano do ensino médio
1) Uma das principais contribuições tecnológicas da Química para o nosso dia-a-dia são as baterias utilizadas, por exemplo, nos aparelhos portáteis. Essas baterias são células eletroquímicas. Na bateria de níquelcádmio(nicad) ocorre a reação: Cd(s) + 2 Ni(OH)3(s) → Cd(OH)2(s) + 2 Ni(OH)2(s) O potencial de célula da bateria é de 1,25V e a constante de Faraday é 96500 C.mol-1. A energia livre da reação em C.V.mol-1 (C.V = 1J) é
- A) + 4,82 x 105.
- B) + 1,21 x 105.
- C) – 1,21 x 105.
- D) – 2,42 x 105.
FAZER COMENTÁRIO- E) – 3,62 x 105.
A alternativa correta é letra D
Primeiramente, devemos analisar as semi-reações de redução e de oxidação:Cd + 2 OH- → Cd(OH)2 + 2 e-2 Ni(OH)3 + 2 e- → 2 Ni(OH)2(s) + 2 OH-Podemos resolver esta questão por análise dimensional:Como o processo da pilha é um processo espontâneo, o valor do ΔG será negativo e, portanto:ΔG = - 2,4 . 105 C . V / molSe preferir, pode usar a fórmula do ΔG:ΔG = - n.F. ΔEonde n = n° de elétronsF = constante de FaradayΔE = potencial da célula.2) (PUCRS) A quantidade de peróxido de hidrogênio em água oxigenada pode ser determinada por titulação com permanganato de potássio conforme a equação 2KMnO4 + 5H2O2 + 3H2SO4 → 2MnSO4 + K2SO4 + 8H2O + 5O2 Pela análise da equação, é correto afirmar que
- A) o H2O2 é o agente oxidante.
- B) o H2SO4 sofre oxidação.
- C) o NOX do manganês no permanganato de potássio é + 5.
- D) o NOX do oxigênio varia de -1 a 0.
FAZER COMENTÁRIO- E) o KMnO4 é o agente redutor.
A alternativa correta é letra D
O Número de Oxidação (Nox) é a tendência de variação do número de elétrons dos elementos, perda ou ganho, no fenômeno da estabilidade química. Determinando-se o Nox de cada um dos elementos, nota-se que a variação do Nox do Mn vai de +7 para +2; e do oxigênio vai de -1 para 0. Dessa forma, o manganês reduz e o oxigênio oxida. Portanto, a resposta correta é a alternativa D.3) A princípio, qualquer reação de oxirredução pode ser usada para gerar corrente elétrica, desde que os processos de redução e oxidação ocorram em compartimentos separados, interligados externamente por um material condutor de elétrons e, internamente, por um condutor de íons (ponte salin
- A). Esse dispositivo é, genericamente, denominado pilha. Abaixo estão relacionadas cinco reações que ocorrem espontaneamente a 25°C.I. 2 H2(g) + O2(g) → 2 H2O(l)II. ZnCl2(aq) + Pb(NO3)2(aq) → PbCl2(s) + Zn(NO3)2(aq)III. Cu2+(aq) + Zn(s) → Cu(s) + Zn2+(aq)IV. Pb(s) + PbO2(s) + 2 H2SO4(aq) → 2 PbSO4(s) + 2 H2O(l)V. 2 NaOH(aq) + H2SO4(aq) → Na2SO4(aq) + 2 H2O(l)Podem ser aplicadas em dispositivos para gerar corrente elétrica as reações FAZER COMENTÁRIO
A alternativa correta é letra C
Substitua este texto...Questão 4
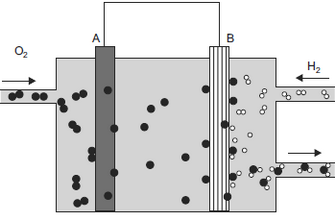 Nesse esquema, os círculos podem representar átomos, moléculas ou íons. De acordo com essas informações e o conhecimento de eletroquímica, pode-se afirmar que nesse dispositivo a corrente elétrica flui de:FAZER COMENTÁRIO
Nesse esquema, os círculos podem representar átomos, moléculas ou íons. De acordo com essas informações e o conhecimento de eletroquímica, pode-se afirmar que nesse dispositivo a corrente elétrica flui de:FAZER COMENTÁRIO- A) A para B e o círculo • representa o íon O2–
- B) B para A e o círculo • representa o íon O2+
- C) B para A e o círculo • representa o íon O2–
- D) A para B e o círculo • representa o íon O2+
A alternativa correta é letra A
Segundo o esquema apresentado verifica-se que em B ocorre a oxidação de H2:H2 → 2 H+ + 2 e–de onde partem os elétrons. Em A ocorre a redução do O2:½ O2 + 2 e– → O2–onde chegam os elétrons. Com isso conclui-se que o fluxo de elétrons é de B para A e a corrente elétrica contrária ao fluxo, de A para B. Portanto, a resposta correta é a alternativa A.Questão 5
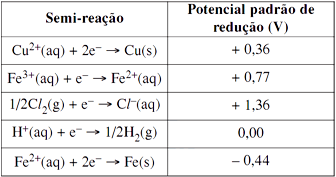 Se uma lâmina de cobre puro for mergulhada em uma solução ácida de cloreto de ferro (III), a 1 mol/L nas condições-padrão, haverá, num primeiro momento,
Se uma lâmina de cobre puro for mergulhada em uma solução ácida de cloreto de ferro (III), a 1 mol/L nas condições-padrão, haverá, num primeiro momento,- A) dissolução do cobre da lâmina
- B) formação de cloro gasoso
- C) liberação de hidrogênio gasoso
- D) depósito de ferro metálico
FAZER COMENTÁRIO- E) formação de mais íons cloreto
A alternativa correta é letra A
As semi-reações, que ocorrem do cobre puro em uma solução ácida de cloreto de ferro(III), são as seguintes:
Cu(s) → Cu2+(aq) + 2e– Eoxi = – 0,36V
2Fe3+(aq) + 2e– → 2Fe2+(aq) Ered = +0,77V
–––––––––––––––––––––––––––––––––––––––––––––
Cu(s) + 2Fe3+(aq) → Cu2+(aq) + 2Fe2+(aq) ΔE = + 0,41VDurante este processo, o potencial utilizado foi positivo, ou seja, ΔE > 0, indicando que a reação é espontânea.Como o processo é espontâneo, a lâmina de cobre sofre oxidação (perda de elétrons) e o produto gerado desta oxidação (Cu2+) é dissolvido na solução ácida de cloreto de ferro (III). Portanto, a alternativa correta é a letra A.6) O conhecimento dos potenciais-padrão permite que se façam previsões quanto à espontaneidade de algumas reações químicas.
FAZER COMENTÁRIO- A) espontânea, com ΔE0 = +0,10 V.
- B) espontânea, com ΔE0 = +2,36 V.
- C) não espontânea, com ΔE0 = +0,10 V.
- D) não espontânea, com ΔE0 = –0,10 V.
- E) não espontânea, com ΔE0 = –2,36 V.
A alternativa correta é letra D
Sabendo que reações de oxirredução são espontâneas quando apresentam valores positivos de ΔE0, devemos avaliar este valor para a reação proposta na questão. Vamos inverter a primeira reação:Agora vamos multiplicar a segunda reação por três:E então, vamos somá-las:Calculando o ΔE0 para a reação global acima, temos:ΔE0= –1,33 V + 1,23 V = –0,10 VPelo valor acima, temos uma reação não espontânea. Portanto, a resposta correta é a alternativa D.7) O cientista e escritor Oliver Sacks, em seu livro Tio Tungstênio, nos conta a seguinte passagem de sua infância: “Ler sobre [Humphry] Davy e seus experimentos estimulou-me a fazer diversos outros experimentos eletroquímicos… Devolvi o brilho às colheres de prata de minha mãe colocando-as em um prato de alumínio com uma solução morna de bicarbonato de sódio [NaHCO3].”
- A) 3Ag+ + Al0 → 3Ag0 + Al3+
- B) Al3+ + 3Ag0 → Al0 + 3Ag+
- C) Ag0 + Na+ → Ag+ + Na0
- D) Al0 + 3Na+ → Al3+ + 3Na0
- E) 3Na0 + Al3+ → 3Na+ + Al0FAZER COMENTÁRIO
A alternativa correta é letra A
Com base nos dados fornecidos, verifica-se que os íons prata têm o maior potencial de redução, ou seja, recebe elétrons facilmente. Logo, os elétrons da reação vem, obrigatóriamente ou do Al ou do Na.Sabemos também, devido ao enunciado, que é a prata em sua forma de óxido ou sulfeto que dá a coloração negra ao objeto. Para devolver o brilho, temos portanto que obter a prata na sua forma Ag0A alternativa correta é a A8) Leia o texto a seguir. O surgimento da câmera fotográfica digital favoreceu o consumo descartável de imagens, mantendo, ainda assim, a preocupação em preservar as fotos baseadas nos processos de captura e revelação com prata. Um dos fatores mais _________ para esse tipo de fotografia é provocado pela combinação de alta umidade relativa do ar e presença de gases como ozônio, pois favorecem a oxidação dos ____________, que formam as imagens, ______________, que _____________ para a formação da imagem.
FAZER COMENTÁRIO- A) danosos; grãos de prata (prata metálic
A alternativa correta é letra B
A preservação da qualidade de fotografias baseadas nos processos de captura e revelação com prata depende do estado de oxidação do elemento metálico.
Dessa forma, a combinação de alta umidade relativa do ar e a presença de gases, como o ozônio, favorecem a oxidação dos grãos de prata (prata metálica) reduzidos em íons de prata. Esse processo químico é danoso à fotografia e não contribui para a imagem.9) Deseja-se armazenar uma solução de NiCl2, cuja concentração é de 1 mol/L a 25°C, e para isso dispõe-se de recipientes de:
- A) I e II, apenas.
- B) I, II e IV, apenas.
- C) III e IV, apenas.
- D) I, III e IV, apenas.
FAZER COMENTÁRIO- E) I, II, III e IV.
A alternativa correta é letra A
Para que um determinado íon reduza espontaneamente, o seu potencial padrão de redução deve ser maior do que o potencial padrão dos outros elementos presentes. No caso do níquel, seu potencial de redução é menor do que os potenciais do estanho e do cobre, ou seja, nesses recipientes, ele não sofrerá a redução, enquanto nos recipientes de ferro e zinco ele sofrerá redução. Sendo assim, a alternativa que melhor representa o resultado encontrado é a de letra A.Continua após a publicidade..10) Considere a tabela de potencial padrão de redução a seguir. Semi-reação E0 (red) / V Al3+ + 3 e- → Al – 1,66 Zn2+ + 2 e- → Zn – 0,76 Fe2+ + 2 e- → Fe – 0,44 Sn2+ + 2 e- → Sn – 0,14 Cu2+ + 2 e- → Cu + 0,34 Ag+ + 1 e- → Ag + 0,80 Os cascos de navios, normalmente feitos de ferro, são protegidos da corrosão mediante a colocação de “metais de sacrifício”, ou seja, metais que sofrem preferencialmente a corrosão. Com base no exposto acima, é correto afirmar:
- A) A corrosão ocorre porque o oxigênio é oxidado e o ferro se transforma em Fe(O
- B)3.
- C) O “metal de sacrifício” deve ter um potencial padrão de redução menor que o do metal que se deseja proteger.
- D) O “metal de sacrifício” deve ser um redutor mais fraco que o ferro.
- E) O “metal de sacrifício” atua doando elétrons como se fosse o cátodo de uma pilha. FAZER COMENTÁRIO
1 2 3 … 6 Próximo »A alternativa correta é letra B
A corrosão é baseada na degradação do material devido à reação de oxirredução, em que o material corroído oxida.A utilização do ânodo de sacrifício está baseada no princípio de que o material escolhido se oxidará no lugar do que deseja-se proteger, ou seja, o ânodo de sacrifício apresenta um menor potencial padrão de redução que o do material protegido.Assim, a resposta correta é a alternativa B. - C) O “metal de sacrifício” deve ter um potencial padrão de redução menor que o do metal que se deseja proteger.
- B) I, II e IV, apenas.
- B) formação de cloro gasoso
- B) o H2SO4 sofre oxidação.
- B) + 1,21 x 105.
