Continua após a publicidade..
A bateria primária de lítio-iodo surgiu em 1967, nos Estados Unidos, revolucionando a história do marcapasso cardíaco. Ela pesa menos que 20g e apresenta longa duração, cerca de cinco a oito anos, evitando que o paciente tenha que se submeter a freqüentes cirurgias para trocar o marca-passo. O esquema dessa bateria é representado na figura.
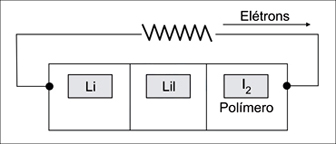
Para esta pilha, são dadas as semi-reações de redução:
Li+ + e- → Li E0 = -3,05VI2 + 2 e- → 2I- E0 = +0,54V
São feitas as seguintes afirmações sobre esta pilha:
I. No ânodo ocorre a redução do íon Li+.
II. A ddp da pilha é + 2,51 V.
III. O cátodo é o polímero/iodo.
IV. O agente oxidante é o I2.
São corretas as afirmações contidas apenas em
- A) I, II e III.
- B) I, II e IV.
- C) I e III.
- D) II e III.
- E) III e IV.
Resposta:
A alternativa correta é letra E
Considerando as afirmações feitas, temos:
I. FALSA, tanto em pilhas quando em eletrólise, ou seja, em reações de oxirredução, no ânodo sempre ocorre oxidação e não redução como foi afirmado;
II. FALSA, sabendo que a diferença de potencial (ddp) de uma pilha é calculada por:
∆E0 = E0maior – E0menor
∆E0 = + 0,54V – (– 3,05V)
∆E0 = + 3,59V
∆E0 = + 3,59V
III. CORRETA, considerando que é no cátodo onde ocorre a semi-reação de redução e que o maior potencial de redução é dado para o iodo, temos a afirmativa correta;
IV. CORRETA, agente oxidante é aquele que causa oxidação em consequência de sua redução, sendo assim o iodo é o agente oxidante.

Deixe um comentário