Continua após a publicidade..
A obtenção de energia é uma das grandes preocupações da sociedade contemporânea e, nesse aspecto, encontrar maneiras efetivas de gerar eletricidade por meio de reações químicas é uma contribuição significativa ao desenvolvimento científico e tecnológico.
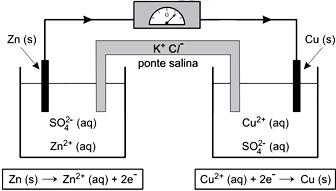
A figura mostra uma célula eletroquímica inventada por John Daniell em 1836. Trata-se de um sistema formado por um circuito externo capaz de conduzir a corrente elétrica e de interligar dois eletrodos que estejam separados e mergulhados num eletrólito. Uma reação química que ocorre nesse sistema interligado leva à produção de corrente elétrica.
Dados:
Zn2+(aq) + 2e– → Zn (s) E0 = – 0,76 V
Cu2+(aq) + 2e– → Cu (s) E0 = + 0,34 V
Zn2+(aq) + 2e– → Zn (s) E0 = – 0,76 V
Cu2+(aq) + 2e– → Cu (s) E0 = + 0,34 V
Com base nessas informações, afirma-se que:
I. Nessa célula eletroquímica, a energia produzida pela reação de oxirredução espontânea é transformada em eletricidade.
II. Os elétrons caminham espontaneamente, pelo fio metálico, do eletrodo de zinco para o de cobre.
III. A reação de redução do Cu2+ consome elétrons e, para compensar essa diminuição de carga, os íons K+ migram para o cátodo através da ponte salina.
IV. A força eletromotriz gerada por essa célula eletroquímica a 25 °C equivale a −1,1 V.
É correto o que se afirma em:
Com base nessas informações, afirma-se que:
I. Nessa célula eletroquímica, a energia produzida pela reação de oxirredução espontânea é transformada em eletricidade.
II. Os elétrons caminham espontaneamente, pelo fio metálico, do eletrodo de zinco para o de cobre.
III. A reação de redução do Cu2+ consome elétrons e, para compensar essa diminuição de carga, os íons K+ migram para o cátodo através da ponte salina.
IV. A força eletromotriz gerada por essa célula eletroquímica a 25 °C equivale a −1,1 V.
É correto o que se afirma em:
Com base nessas informações, afirma-se que:
I. Nessa célula eletroquímica, a energia produzida pela reação de oxirredução espontânea é transformada em eletricidade.
II. Os elétrons caminham espontaneamente, pelo fio metálico, do eletrodo de zinco para o de cobre.
III. A reação de redução do Cu2+ consome elétrons e, para compensar essa diminuição de carga, os íons K+ migram para o cátodo através da ponte salina.
IV. A força eletromotriz gerada por essa célula eletroquímica a 25 °C equivale a −1,1 V.
É correto o que se afirma em:
- A) I, II e III, apenas.
- B) I, II e IV, apenas.
- C) I, III e IV, apenas.
- D) II, III e IV, apenas.
- E) I, II, III e IV.
Resposta:
A alternativa correta é letra A
A assertiva I está correta: pilhas são formadas pela reação espontânea de oxirredução que geram elétrons. A assertiva II também está correta: podemos observar que o cobre possui maior potencial de redução e, assim, irá se reduzir, ou seja, receberá elétrons; o zinco por sua vez possui um alto potencial de oxidação e irá oxidar, liberando elétrons. A assertiva III também está correta: a ponte salina tem por função manter o meio neutro em relação a cargas. E, por fim, a assertiva IV está incorreta: numa reação espontânea de oxirredução o potencial é sempre positivo. Estão coerentes as assertivas I, II e III, portanto, a resposta correta é a alternativa A.

Deixe um comentário