Continua após a publicidade..
As naves espaciais utilizam pilhas de combustível, alimentadas por oxigênio e hidrogênio, as quais, além de fornecerem a energia necessária para a operação das naves, produzem água, utilizada pelos tripulantes. Essas pilhas usam, como eletrólito, o KOH(aq), de modo que todas as reações ocorrem em meio alcalino. A troca de elétrons se dá na superfície de um material poroso. Um esquema dessas pilhas, com o material poroso representado na cor cinza, é apresentado a seguir.
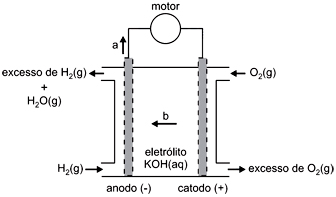
Escrevendo as equações das semirreações que ocorrem nessas pilhas de combustível, verifica-se que, nesse esquema, as setas com as letras a e b indicam, respectivamente, o sentido de movimento dos
- A) íons OH– e dos elétrons.
- B) elétrons e dos íons OH–.
- C) íons K+ e dos elétrons.
- D) elétrons e dos íons K+.
- E) elétrons e dos íons H+.
Resposta:
A alternativa correta é letra B
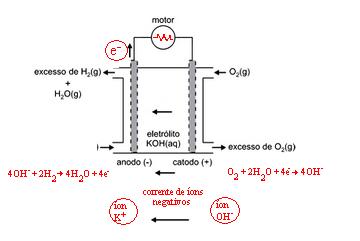
Para determinar as letras a e b precisamos escrever as semirreações que ocorrem nos eletrodos:
Ânodo - Oxidação do Hidrogênio
H2 → 2H+ + 2e–
Cátodo - Redução do Oxigênio
O2 + 4H+ → 2H2O
Equação global
H2 + 1/2 O2 → H2O
Assim já podemos determinar a letra a, no ânodo esta ocorrendo a oxidação do hidrogênio e a letra a representa a passagem de elétrons.
Agora para determinarmos a letra b, utilizaremos o método de balanceamento em meio alcalino, adicionando OH- em ambos os lados da equação sem alterar a equação global:
Ânodo - Oxidação do Hidrogênio
H2 + 2OH– → 2H+ + 2OH– + 2e–
⇓
H2 + 2OH– → 2H2O + 2e–
Cátodo - Redução do Oxigênio
O2 + 4H+ + 4OH– + 4e– → 2H2O + 4OH–
O2 + 2H2O + 4e– → 4OH–
Agora balanceando o número de elétrons, escrevemos:
Ânodo - Oxidação do Hidrogênio
4OH- + 2H2 → 4H2O + 4e-
Cátodo - Redução do Oxigênio
O2 + 2H2O + 4e- → 4OH-
Equação global
H2 + 1/2 O2 → H2O
Assim determinamos a letra b, a corrente de íons negativos esta indo da direita para a esquerda então os íons OH- negativos também vai nesse sentido:

Deixe um comentário