Questões Sobre Eletroquímica - Química - 2º ano do ensino médio
11) Assinale a alternativa incorreta:
- A) Eletrólise ígnea é a reação química provocada pela passagem de corrente elétrica através de um composto iônico fundido.
- B) Eletrólise aquosa é a reação química provocada pela passagem de corrente elétrica por meio de uma solução aquosa de um eletrólito.
- C) Com a eletrólise podemos produzir substâncias na indústria química como a soda cáustica e hipocloritos.
- D) A ddp negativa indica que a reação é espontânea e que poderá ser usada para gerar corrente elétrica.
- E) Na eletrólise de uma solução aquosa de KI, o íon iodeto, quando volta a ser átomo, perde um
elétron.FAZER COMENTÁRIOA alternativa correta é letra D
A única afirmativa errada é a relacionada à ddp negativa, pois o valor negativo indica que os eletrodos estão invertidos para ser realizada a medida, já que o caminho dos elétrons na reação espontânea é do eletrodo negativo (oxidação) para o positivo (redução), o que mostra um valor positivo. Assim, quando o valor é negativo, indica que os eletrodos de medição estão em posições trocadas, ou seja, o medidor positivo está no eletrodo que oxida, e o medidor negativo está no eletrodo positivo.Portanto, a resposta correta é a alternativa D.12) Os potenciais padrão de redução também são bastante úteis para se obter informações sobre o caminho de uma reação. Dentre as reações a seguir equacionadas, a que representa o sentido espontâneo da reação é:
FAZER COMENTÁRIO- A) FeCl2(aq) + Ni(s) → NiCl2(aq) + Fe(s)
- B) MgCl2(aq) + Cu(s) → Mg(s) + CuCl2(aq)
- C) Zn(NO3)2(aq) + Fe(s) → Fe(NO3)2(aq) + Zn(s)
- D) CuCl2(aq) + Ni(s) → Cu(s) + NiCl2(aq)
- E) Mg(NO3)2(aq) + Zn(s) → Mg(s) + Zn(NO3)2(aq)
A alternativa correta é letra D
Observando cada uma das reações, juntamente com os potenciais-padrão de redução de cada espécie envolvida, pode-se dizer que a única reação espontânea é a da alternativa D, em que ocorre a oxidação do níquel e a redução do cobre. É espontânea pelo fato do potencial-padrão de redução do níquel ser menor que o do cobre, indicando que o primeiro oxida, e o outro reduz, quando estiverem em reação; e esse fato é o descrito pela reação. Portanto, a resposta correta é a alternativa D.13) Um tipo de lente fotocrômica utilizada em óculos contém AgCl e CuCl dispersos no vidro da lente. O funcionamento da lente fotocrômica envolve duas fases, a luminosa e a escura. Na fase luminosa, em presença de luz intensa, ocorrem as semi-reações: I. Cl– →Luz Cl + e– II. Ag+ + e– → Ag A prata metálica é formada quase instantaneamente e escurece o vidro. Em ambiente com pouca luz, ocorre a fase escura, envolvendo as reações: III. Cl + Cu+ → Cu2+ + Cl– IV. Cu2+ + Ag → Cu+ + Ag+ responsáveis pela restauração da transparência inicial da lente. Com relação aos processos envolvidos na atuação de uma lente fotocrômica, pode-se afirmar que:
- A) todos os produtos da reação global que ocorre na fase luminosa sofreram redução, pelo fato de a luz estar envolvida na primeira semi-reação desta fase.
- B) os produtos da reação global que ocorre na fase escura são Cu+ e Ag+.
- C) na reação III, Cu+ é reduzido a Cu2+, sendo o agente oxidante do processo.
- D) na reação IV, Ag é oxidado a Ag+, sendo o agente redutor do processo.
FAZER COMENTÁRIO- E) a lente assume cor esverdeada quando exposta à luz, pois se sabe que o Cl formado na etapa I é um produto gasoso esverdeado.
A alternativa correta é letra D
Observando a reação IV, nota-se que a prata (Ag) tem seu número de oxidação aumentado ao passar para Ag+, indicando que sofreu oxidação, doando um elétron. Assim, por sofrer este processo de oxidação, Ag é denominada agente redutor da reação global, pois provoca a redução do Cl.Portanto, a resposta correta é a alternativa D.Questão 14
 Analisando as equações apresentadas, é correto afirmar que no processo de degradação aeróbica ocorrem reações de:FAZER COMENTÁRIO
Analisando as equações apresentadas, é correto afirmar que no processo de degradação aeróbica ocorrem reações de:FAZER COMENTÁRIO- A) decomposição, em que o oxigênio não sofre alteração em seu número de oxidação.
- B) oxirredução, em que o oxigênio atua como agente redutor.
- C) decomposição, em que o oxigênio perde elétrons.
- D) oxirredução, em que o oxigênio sofre oxidação.
- E) oxirredução, em que o oxigênio atua como agente oxidante.
A alternativa correta é letra E
Nas duas equações ocorre oxidação e redução; em ambos os casos o oxigênio sofre redução (seu nox passa de zero para −2), atuando como agente oxidante. Portanto, a resposta correta é a alternativa E.15) Amílcar de Castro, em sua obra, utilizou o ferro sem qualquer pintura ou proteção contra corrosão, para que pudesse ser observada a ação do tempo sobre a mesma. Com base nos conhecimentos sobre o tema, é correto afirmar:
- A) O ferro presente na obra sofreu um processo de redução pelo ganho de elétrons.
- B) O processo de deterioração é desacelerado pela ação da água proveniente da chuva.
- C) A proteção do ferro (Fe3+ + 3e– → Feo E0= - 0,04
- D) presente na obra poderia ser realizada pela conexão desta com uma placa de cobre (Cu+ + e– → Cu, E0 = + 0,52
- E). FAZER COMENTÁRIO
A alternativa correta é letra D
O processo de corrosão do ferro é altamente relacionado ao potencial padrão de redução do mesmo, que em contato com a água e o oxigênio ambiente, sofre oxidação.Outra característica do processo corrosivo é o aumento da taxa de corrosão com o aumento da área superficial.Portanto, a resposta correta é a alternativa D.16) A obtenção de metais puros por eletrodeposição é uma das aplicações práticas da eletroquímica. A eletrodeposição pode ser entendida como uma reação entre elétrons e íons.
- A) 1,0 g
- B) 2,0 g
- C) 3,0 g
- D) 9,0 g
FAZER COMENTÁRIO- E) 27,0 g
A alternativa correta é letra A
Temos a fórmula:onde:i = corrente (A = C/s)
Q = carga (C)
t = tempo (s)
Para t = 3 horas = 10800 segundos, e i = 1 A, aplicando a fórmula, temos:Sabendo que um mol de elétrons tem a carga de 96.500 C, a carga Q = 10.800 C corresponde a 0,112 mol de elétrons. Para um mol do composto Al2SO3, tem-se 2 mol de alumínio.Logo,27 g Al − 3 mol e−
x − 0,112 mol e−
x = 1 gEntão, 0,112 mol de elétrons resulta em 1,0 g de Al. Portanto, a resposta correta é a alternativa A.17) Em uma eletrólise, ocorre, em um dos eletrodos, a seguinte reação de redução:
FAZER COMENTÁRIO- A) 19,3 × 103.
- B) 48,2 × 103.
- C) 60,0 × 103.
- D) 96,5 × 103.
- E) 193 × 103.
A alternativa correta é letra D
Analisando a equação de redução, tem-se que a razão molar entre níquel formado e elétrons necessários é igual a 1:2, dessa forma, para se produzir 0,5 mol de Ni(s), deve-se utilizar 1 mol de elétrons.Sabendo a quantidade de elétrons necessária, calcula-se a carga equivalente da seguinte maneira:Portanto, a resposta correta é a alternativa D.Questão 18
A figura representa uma célula de eletrólise de soluções aquosas com eletrodo inerte. Também são fornecidos os potenciais-padrão de redução (E0) de algumas espécies. Na+(aq) + e– → Na(s) E0 = -2,71 V2 H+(aq) + 2 e– → H2(g) E0 = 0,00 VH2O(l) + 1/2 O2 + 2 e– → 2 OH–(aq) E0 = +0,40 VCl2(g) + 2 e– → 2 Cl–(aq) E0 = +1,36 VPara essa célula, foram feitas as seguintes afirmações:I. O pólo positivo é o eletrodo do compartimento Y.II. O ânodo é o eletrodo do compartimento X.III. A ddp para a eletrólise de uma solução aquosa de NaCl(aq) é positiva.IV. Na eletrólise de solução aquosa de NaCl(aq) há formação de gás hidrogênio no eletrodo do compartimento Y.V. Na eletrólise de solução aquosa de NaCl(aq) há formação de gás cloro no compartimento X.São corretas somente as afirmaçõesPara essa célula, foram feitas as seguintes afirmações:I. O pólo positivo é o eletrodo do compartimento Y.II. O ânodo é o eletrodo do compartimento X.III. A ddp para a eletrólise de uma solução aquosa de NaCl(aq) é positiva.IV. Na eletrólise de solução aquosa de NaCl(aq) há formação de gás hidrogênio no eletrodo do compartimento Y.V. Na eletrólise de solução aquosa de NaCl(aq) há formação de gás cloro no compartimento X.IV. Na eletrólise de solução aquosa de NaCl(aq) há formação de gás hidrogênio no eletrodo do compartimento Y.V. Na eletrólise de solução aquosa de NaCl(aq) há formação de gás cloro no compartimento X.São corretas somente as afirmações
Na+(aq) + e– → Na(s) E0 = -2,71 V2 H+(aq) + 2 e– → H2(g) E0 = 0,00 VH2O(l) + 1/2 O2 + 2 e– → 2 OH–(aq) E0 = +0,40 VCl2(g) + 2 e– → 2 Cl–(aq) E0 = +1,36 VPara essa célula, foram feitas as seguintes afirmações:I. O pólo positivo é o eletrodo do compartimento Y.II. O ânodo é o eletrodo do compartimento X.III. A ddp para a eletrólise de uma solução aquosa de NaCl(aq) é positiva.IV. Na eletrólise de solução aquosa de NaCl(aq) há formação de gás hidrogênio no eletrodo do compartimento Y.V. Na eletrólise de solução aquosa de NaCl(aq) há formação de gás cloro no compartimento X.São corretas somente as afirmaçõesPara essa célula, foram feitas as seguintes afirmações:I. O pólo positivo é o eletrodo do compartimento Y.II. O ânodo é o eletrodo do compartimento X.III. A ddp para a eletrólise de uma solução aquosa de NaCl(aq) é positiva.IV. Na eletrólise de solução aquosa de NaCl(aq) há formação de gás hidrogênio no eletrodo do compartimento Y.V. Na eletrólise de solução aquosa de NaCl(aq) há formação de gás cloro no compartimento X.IV. Na eletrólise de solução aquosa de NaCl(aq) há formação de gás hidrogênio no eletrodo do compartimento Y.V. Na eletrólise de solução aquosa de NaCl(aq) há formação de gás cloro no compartimento X.São corretas somente as afirmações- A) I, II, III e IV.
- B) I, III e V.
- C) I, IV e V.
- D) II, III, IV.
FAZER COMENTÁRIO- E) II, IV e V.
A alternativa correta é letra E
Analisando o sistema esquematizado no enunciado, a presença de uma bateria e a ausência de uma ponte salina nos indica que estamos lidando com uma cuba eletrolítica, utilizada em eletrólises - processo não espontâneo que ocorre na presença de um gerador (bateria).Assim, sabendo que em uma eletrólise o fluxo de elétrons ocorre do pólo positivo (ânodo), para o pólo negativo (cátodo), temos que o compartimento Y corresponde ao pólo negativo (cátodo), fato que nos leva a descartar a primeira afirmação I e considerar correta a afirmação II, que diz que o compartimento X refere-se ao ânodo. Na afirmação III é dito que a ddp para a eletrólise de uma solução aquosa de NaCl(aq) é positiva, o que não é verdade, uma vez que temos o fornecimento de energia ao sistema por intermédio da bateria. Com base nos potenciais padrões fornecidos, e sabendo que no cátodo ocorre uma semi-reação de redução, temos, na eletrólise de uma solução aquosa de NaCl(aq), a redução da água no cátodo segunda a seguinte equação:2 H2O + 2 e- → H2 + 2 OH-Tal fato é conseqüência do maior potencial padrão de redução da água, onde o hidrogênio é reduzido de hidrogênio +1, o que classifica a afirmação IV como correta. Por fim, de acordo com o mesmo raciocínio apresentado anteriormente, como temos um menor potencial padrão de redução para o gás cloro (Cl2), ou seja, uma maior potencial de oxidação, temos a oxidação de Cl- no ânodo, levando a formação de gás cloro. Deste modo, a alternativa correta é a que nos remete as afirmações II, IV e V como corretas, ou seja, a alternativa "E".Questão 19
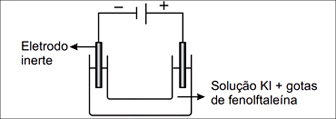 São fornecidos os potenciais padrão de redução das espécies químicas presentes na solução, que podem sofrer óxido-redução no processo.Com base nesses dados, pode-se prever que, durante a eletrólise da solução, haverá desprendimento de gás
São fornecidos os potenciais padrão de redução das espécies químicas presentes na solução, que podem sofrer óxido-redução no processo.Com base nesses dados, pode-se prever que, durante a eletrólise da solução, haverá desprendimento de gás- A) em ambos os eletrodos, e aparecimento de cor vermelha apenas ao redor do eletrodo negativo.
- B) em ambos os eletrodos, e aparecimento de cor vermelha apenas ao redor do eletrodo positivo.
- C) em ambos os eletrodos, e aparecimento de cor vermelha também ao redor dos dois eletrodos.
- D) somente do eletrodo positivo, e deposição de potássio metálico ao redor do eletrodo negativo.
- E) somente do eletrodo negativo, e aparecimento de cor vermelha apenas ao redor do mesmo eletrodo.
FAZER COMENTÁRIOA alternativa correta é letra E
Tomar cuidado com as definições:redução → eletrodo negativo → cátodooxidação →eletrodo positivo → ânodoAs reações que ocorrerão na pilha serão:redução - cátodo2H2O(l) + 2e-→ H2(g) + 2OH-(aq)oxidação - ânodo2I-(aq) → I2 + 2 e-Reação geral2H2O + 2I- → H2(g) + I2No eletrodo negativo (cátodo) há o despreendimento de gás hidrogênio liberado pela reação, além do aparecimento da cor vermelha devido aos íons OH- em formação na soluçãoContinua após a publicidade..Questão 20
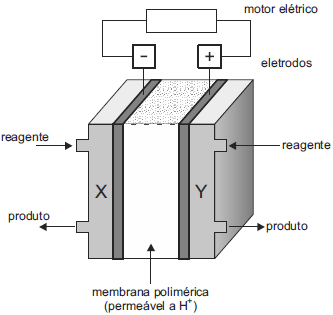
 Sobre a célula de hidrogênio esquematizada, é correto afirmar queFAZER COMENTÁRIO
Sobre a célula de hidrogênio esquematizada, é correto afirmar queFAZER COMENTÁRIO- A) ocorre eletrólise durante o processo.
- B) ocorre consumo de energia no processo.
- C) o ânodo é o polo positivo da célula combustível.
- D) a proporção entre os gases reagentes é 2H2 : 1O2.
- E) o reagente que deve ser adicionado em X é o oxigênio.
A alternativa correta é letra D
O anodo corresponde ao polo negativo da célula de hidrogênio, cuja semirreação é:
H2 → 2 H+ + 2 e-
O reagente X corresponde ao gás hidrogênio. - B) em ambos os eletrodos, e aparecimento de cor vermelha apenas ao redor do eletrodo positivo.
- B) I, III e V.
- B) 2,0 g
- B) O processo de deterioração é desacelerado pela ação da água proveniente da chuva.
- B) os produtos da reação global que ocorre na fase escura são Cu+ e Ag+.
- B) Eletrólise aquosa é a reação química provocada pela passagem de corrente elétrica por meio de uma solução aquosa de um eletrólito.
