Questões Sobre Eletroquímica - Química - 2º ano do ensino médio
Questão 21

Dados:
Mg2+(aq) + 2e → Mg(s) E0 = -2,36V
Pb2+(aq) + 2e → Pb(s) E0 = -0,13V
2H+(aq) + 2e → H2(g) E0 = 0,00V
Dados:
Mg2+(aq) + 2e → Mg(s) E0 = -2,36V
Pb2+(aq) + 2e → Pb(s) E0 = -0,13V
2H+(aq) + 2e → H2(g) E0 = 0,00V
Sobre essa célula, assinale a alternativa INCORRETA.
Sobre essa célula, assinale a alternativa INCORRETA.
- A) A placa de magnésio é o pólo positivo.
- B) O suco de limão é a solução eletrolítica.
- C) Os elétrons fluem da placa de magnésio para a placa de chumbo através do circuito externo.
- D) A barra de chumbo é o catodo.
FAZER COMENTÁRIO- E) No anodo ocorre uma semi-reação de oxidação.
A alternativa correta é letra A
Analisando os potenciais-padrão de redução dos dois elementos, o chumbo e o magnésio, pode-se concluir que na célula eletrolítica, o chumbo sofre redução e o magnésio se oxida, dessa forma, são os pólos negativo e positivo, respectivamente, ou seja, cátodo e ânodo.Portanto, a resposta incorreta é a alternativa A.Questão 22
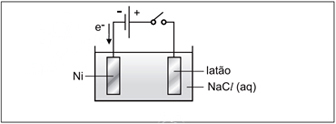 No entanto, devido a erros experimentais, ao fechar o circuito, não ocorreu a niquelação da peça. Para que essa ocorresse, foram sugeridas as alterações:I. Inverter a polaridade da fonte de corrente contínua.
No entanto, devido a erros experimentais, ao fechar o circuito, não ocorreu a niquelação da peça. Para que essa ocorresse, foram sugeridas as alterações:I. Inverter a polaridade da fonte de corrente contínua.
II. Substituir a solução aquosa de NaCl por solução aquosa de NiSO4.
III. Substituir a fonte de corrente contínua por uma fonte de corrente alternada de alta frequência.
O êxito do experimento requereria apenas- A) a alteração I.
- B) a alteração II.
- C) a alteração III.
FAZER COMENTÁRIO- D) as alterações I e II.
- E) as alterações II e III.
A alternativa correta é letra D
I) Verdadeira, na figura, o Níquel é o ânodo da reação, ou seja o polo negativo, sofrendo oxidação, entretanto, para ocorrer a niquelação o Níquel deve sofrer redução, tornando-se o cátodo da reação (polo negativo), para isso deve-se inverter a polaridade da corrente.II) Verdadeira, é necessária a presença de Ni2+ em solução para que ocorra a niquelação, por isso é necessário substituir a solução de Nacl por uma solução de um sal de Níquel.III)Falsa, a eletrólise só ocorre com correntes continuas.Desse modo, D é correta.Questão 23
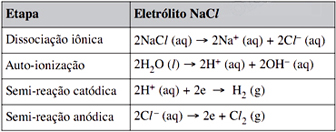
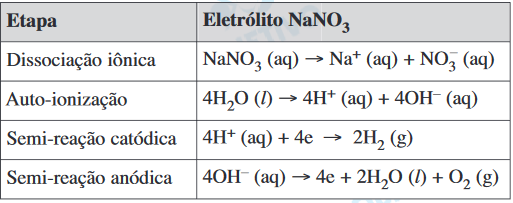 Com base nas semi-reações apresentadas, é correto afirmar que,FAZER COMENTÁRIO
Com base nas semi-reações apresentadas, é correto afirmar que,FAZER COMENTÁRIO- A) para produção de H2, o eletrólito de NaCl é mais eficiente.
- B) para produção de H2, o eletrólito de NaNO3 é mais eficiente.
- C) na eletrólise de solução aquosa de NaCl, o eletrólito não é consumido.
- D) na eletrólise de solução aquosa de NaNO3, o eletrólito é consumido.
- E) na eletrólise de solução aquosa de NaCl, todos os produtos da reação são gases.
A alternativa correta é letra B
As reações globais que ocorrem são:
Como 2 moles de água são utilizados como reagente em ambas as reações e, a quantidade de H2 produzido (em mol) é maior para o eletrólito NaNO3, este eletrólito é, portanto, mais eficiente.24) Um cubo de 1cm de aresta foi utilizado como eletrodo em uma eletrólise de solução aquosa contendo íons Ag+, sob corrente elétrica de 1A para que nele se deposite uma película de prata de 5×10-4cm de espessura. O tempo de eletrólise deverá ser de, aproximadamente, Dados: Densidade da prata = 10,5 g/cm3 Massa molar da prata = 108 g/mol 1 faraday = 1 × 105 C/mol
- A) 10 s.
- B) 20 s.
- C) 30 s.
- D) 40 s.
FAZER COMENTÁRIO- E) 50 s.
A alternativa correta é letra C
Primeiramente, deve-se encontrar a quantidade em mols de prata presente no depósito, isso é feito abaixo.- Cálculo do volume de prata:- Usando a densidade e massa molar da prata:O tempo de eletrólise é determinado da seguinte forma:Portanto, a resposta correta é a alternativa C.25) A prateação pelo processo galvânico é de grande utilidade, tendo em vista que com um gasto relativamente pequeno consegue-se dar uma perfeita aparência de prata aos objetos tratados. A massa de prata (em gramas), depositada durante a prateação de uma pulseira de bijuteria, na qual foi envolvida uma carga equivalente a 4825 C, corresponde aproximadamente a:
- A) 54 g.
- B) 27 g.
- C) 10,8 g.
- D) 5,4 g.
FAZER COMENTÁRIO- E) 1,08 g
A alternativa correta é letra D
A quantidade de prata depositada é determinada pela seguinte equação, utilizando a constante de Faraday:Q = F. nn = 4825/ 96485n =0,05 molA massa de prata é, então:m = n x MMm = 0,05 x 107, 868m = 5,4 gPortanto, a resposta correta é a alternativa D.26) Em relação ao processo eletrolítico para a produção de cloro e soda, é correto afirmar que:
- A) os íons Na+ e as moléculas de H2O migram através da membrana na direção do ânodo.
- B) forma-se gás hidrogênio no cátodo e gás cloro no ânodo.
- C) no cátodo, é formado o gás cloro através do recebimento de elétrons.
- D) os elétrons migram, através de contato elétrico externo, do pólo negativo para o pólo positivo da célula.
FAZER COMENTÁRIO- E) para cada mol de gás hidrogênio formado, é necessário um mol de elétrons.
A alternativa correta é letra B
Analisando a figura, nota-se que se trata de um esquematização da produção de soda através da eletrólise aquosa do NaCl.Assim, o eletrodo negativo (cátodo) é caracterizado, na eletrólise, pelas reações de redução, ou seja, ocorre a redução do H+, liberando OH- na solução e formando H2.Já no eletrodo positivo (ânodo), há a reação de oxidação do Cl- contido na solução, liberando o cátion Na+ e formando Cl2.Com isso, ocorre a formação de NaOH em solução devido a liberação de OH- e Na+.Portanto, a resposta correta é a alternativa B.27) “Primeiramente separamos a sucata eletrônica por classe, efetuamos a destruição através da moagem e exportamos para a usina. Lá é feita uma desintoxicação (processo de elevação de temperatura em câmara selada a 1200 °C e resfriamento em 4 segundos para 700 °C), filtragem de dioxinas, liquidificação, separação por densidade, separação por eletrólise, decantação, refinagem e solidificação em barras.”
- A) II, apenas.
- B) I e III, apenas.
- C) I e II, apenas.
- D) II e III, apenas.
FAZER COMENTÁRIO- E) I, II e III.
A alternativa correta é letra E
Analisando cada afirmativa, obtemos que :I - Verdadeira. A decantação é um processo de separação, utilizado em misturas heterogêneas. Existem diversos métodos de decantação, como a sifonação e funil de bromo.II- Verdadeira. Como dito no texto, a desintoxicação consiste em aquecer o objeto e depois resfriá-lo rapidamente. O texto diz que um objeto de 1200 ºC resfria-se durante 4 segundos e passa ter temperatura de 700 ºC. Logo, conclui-se que a cada 1 segundo, o corpo resfria-se 125 ºC.III - Verdadeira. A eletrólise é um processo químico onde os elementos químicos de um composto são separados pelo uso da eletricidade.Alternativa correta é a letra E.28) Os sais de chumbo constituem-se num grave problema ambiental, pois se ingeridos provocam doenças neurológicas irreversíveis. Numa indústria, quer-se desenvolver um método eletroquímico para depositar chumbo metálico no tratamento do seu efluente. Considere os seguintes valores de potenciais-padrão de redução em meio ácido:
- A) o cobre.
- B) a prata.
- C) o níquel.
- D) o zinco.
FAZER COMENTÁRIO- E) o alumínio.
A alternativa correta é letra E
Deve-se saber que quanto maior a diferença total de potencial, mais rápida será a reação, ou seja, como se deseja reduzir o Pb2+, deve-se utilizar um metal que tenha um potencial de redução muito baixo. Assim, o metal a ser utilizado deverá ser o alumínio, pois dentre os fornecidos é aquele que se oxida mais facilmente, isto é, aquele que facilita a redução do chumbo, fazendo com que a reação seja mais rápida. Portanto, a resposta correta é a alternativa E.29) A reação que se processa no ânodo, na eletrólise de uma solução de cloreto de sódio é:
FAZER COMENTÁRIO- A) Na+ + e- → Na
- B) 2 H2O + 2 e- → H2 + 2 OH-
- C) 2H+ + 2 e- → H2
- D) 2Cl- → Cl2 + 2 e-
- E) 2Cl- + 2H2O → H2 + Cl2 + 2 OH-
A alternativa correta é letra D
Na eletrólise, a polaridade do ânodo e cátodo são contrárias em relação às pilhas, assim, o ânodo na eletrólise de uma solução de NaCl apresenta pólo positivo.Com isso, os ânions estão ao redor do ânodo, e ocorre a reação de oxidação, liberando elétrons até o cátodo.Assim, a única reação que representa essa oxidação, é a do Cl-, que forma o Cl2 e libera dois elétrons.Portanto, a resposta correta é a alternativa D.Continua após a publicidade..30) O uso industrial do cloreto de sódio se dá principalmente no processo de obtenção de alguns importantes produtos de sua eletrólise em meio aquoso. Simplificadamente, esse processo é feito pela passagem de uma corrente elétrica em uma solução aquosa desse sal. Pode-se afirmar que a partir desse processo, seriam obtidos:
- A) gás hidrogênio, gás oxigênio e ácido clorídrico.
- B) gás hidrogênio, gás cloro e hidróxido de sódio em solução.
- C) gás hidrogênio, gás cloro e ácido clorídrico.
FAZER COMENTÁRIO- D) gás hidrogênio, gás oxigênio e hidróxido de sódio em solução.
« Anterior 1 2 3 4 5 6 Próximo »A alternativa correta é letra B
Quando o cloreto de sódio é diluído em solução aquosa com corrente elétrica, ocorrem as seguintes reações:
Dissociação do NaCl:2 NaCl → 2 Na+ + 2 Cl-Autoionização da água:2 H2O → 2 H+ + 2 OH-Semirreação no cátodo:2 H+ + 2 e- → H2Semirreação no ânodo:2 Cl- → Cl2 + 2 e-Assim, temos a seguinte reação global:2 NaCl + 2 H2O → 2 NaOH + H2 + Cl2Observe também a figura a seguir: Assim, a partir desse processo, podemos perceber que são liberados gás hidrogênio, gás cloro e hidróxido de sódio em solução. Portanto, a resposta correta é a alternativa B.
Assim, a partir desse processo, podemos perceber que são liberados gás hidrogênio, gás cloro e hidróxido de sódio em solução. Portanto, a resposta correta é a alternativa B. - C) gás hidrogênio, gás cloro e ácido clorídrico.
- B) a prata.
- B) I e III, apenas.
- B) forma-se gás hidrogênio no cátodo e gás cloro no ânodo.
- B) 27 g.
- B) 20 s.
- B) O suco de limão é a solução eletrolítica.
