Questões Sobre Eletroquímica - Química - 2º ano do ensino médio
31) O hidrogênio está sendo exaustivamente pesquisado como fonte de energia. Qual dos processos abaixo você julga mais conveniente para a obtenção dessa substância?
- A) Liquefação e destilação fracionada do ar.
- B) Eletrólise da água.
- C) Decomposição da água oxigenada.
- D) Destilação do petróleo.
FAZER COMENTÁRIO- E) Fermentação da cana-de-açúcar
A alternativa correta é letra B
A obtenção de H2 pode ser feita pela eletrólise da água, obedecendo a seguinte equação química (lembrando que há o fornecimento de energia elétrica para a reação ocorrer):2 H2O (l) → O2(g) + H2 (g)Portanto, a resposta correta é a alternativa B.32) A eletrólise é um fenômeno que pode ser definido como sendo reação de:
- A) oxi-redução
- B) dupla troca
- C) precipitação eletrolítica
- D) volatilização catódica e acudia
FAZER COMENTÁRIO- E) deslocamento.
A alternativa correta é letra A
A reação de eletrólise é encarada como uma reação de oxi-redução, sendo que há a transferência de elétrons entre as duas espécies envolvidas.Portanto, a resposta correta é a alternativa A.Questão 33
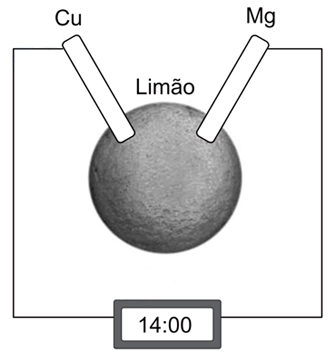 O suco ácido do limão faz o contato entre a fita de magnésio e o fio de cobre, e a corrente elétrica produzida é capaz de acionar o relógio.Dados:Com respeito a esse circuito, pode-se afirmar que:
O suco ácido do limão faz o contato entre a fita de magnésio e o fio de cobre, e a corrente elétrica produzida é capaz de acionar o relógio.Dados:Com respeito a esse circuito, pode-se afirmar que:- A) se o fio de cobre for substituído por um eletrodo condutor de grafite, o relógio não funcionará.
- B) no eletrodo de magnésio ocorre a semi-reação
Mg(s) → Mg2+ + 2e–.- C) no eletrodo de cobre ocorre a semi-reação
Cu2+ + 2e– → Cu(s).- D) o fluxo de elétrons pelo circuito é proveniente do eletrodo de cobre.
- E) a reação global que ocorre na pilha é
Cu2+ + Mg(s) → Cu(s) + Mg2+.FAZER COMENTÁRIOA alternativa correta é letra B
O cobre nessa pilha servirá apenas de eletrodo suporte, não participará da reação, ou seja não fornecerá íons para a solução nem, tão pouco, será reduzidoPrecisamos analisar os dados contidos na tabela:A pilha formada será entre o Magnésio e o Hidrogênio. O Magnésio, com menor potencial de redução, será oxidado:Mg(s) → Mg 2+ + 2e-Enquanto que o Hidrogênio será reduzido:2H+ + 2 e- →H2 (g)A equação global da pilha será:2H+ + Mg (s) → H2 (g) + Mg 2+Resposta BQuestão 34
Dados: P = U.i Carga de um mol de elétrons = 96 500C Massas molares (g.mol–1): Zn = 65,4; Cu = 63,5 Cu+2 + 2 e– ? Cu Zn+2 + 2 e– ? Zn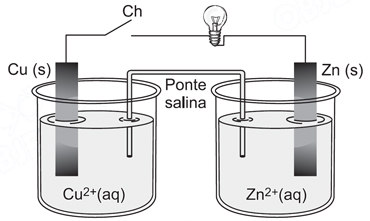 Considerando que a corrente elétrica se manteve constante nesse intervalo de tempo, a potência dissipada pela lâmpada nesse período foi de:
Considerando que a corrente elétrica se manteve constante nesse intervalo de tempo, a potência dissipada pela lâmpada nesse período foi de:- A) 1,1 mW.
- B) 1,1 W.
- C) 0,55 mW.
- D) 96 500 W.
FAZER COMENTÁRIO- E) 0,22 mW.
A alternativa correta é letra A
No eletrodo de cobre ocorre a seguinte reação:Cu2+(aq) + 2 e- → Cu(s)a corrente elétrica é gerada pela movimentação de elétrons livres em solução, assim temos:1 mol de e- ------- 96500 C2 mos de e- -------- 2 . 96500C ------ 63,5 g de Cux ------- 63,5 . 10-6 gx = 0,193 C1 C é definido pela quantidade de carga elétrica carregada por uma corrente de 1A durante 1s, logo:x = i.t = 0,193i.193 = 0,193i = 1 . 10-3 AComo P = U . iP = 1,1 V. 1.10-3AP = 1,1.10-3 W = 1,1 mWAssim, a potência dissipada pela lâmpada nesse período foi foi de 1,1mW, o que nos remete a alternativa A.Questão 35
Atualmente, a indústria produz uma grande variedade de pilhas e baterias, muitas delas impossíveis de serem produzidas sem as pesquisas realizadas pelos eletroquímicos nas últimas décadas. Para todas as reações que ocorrem nestas pilhas e baterias, utiliza-se o valor de E0 do eletrodo-padrão de hidrogênio, que convencionalmente foi adotado como sendo 0 V. Com base nesse referencial, foram determinados os valores de E0 a 25ºC para as semicelas a seguir. * eletrodo-padrão
* eletrodo-padrão** em relação ao eletrodo-padrão
Atualmente, a indústria produz uma grande variedade de pilhas e baterias, muitas delas impossíveis de serem produzidas sem as pesquisas realizadas pelos eletroquímicos nas últimas décadas. Para todas as reações que ocorrem nestas pilhas e baterias, utiliza-se o valor de E0 do eletrodo-padrão de hidrogênio, que convencionalmente foi adotado como sendo 0 V. Com base nesse referencial, foram determinados os valores de E0 a 25ºC para as semicelas a seguir. * eletrodo-padrão
* eletrodo-padrão** em relação ao eletrodo-padrão
 * eletrodo-padrãoCaso o valor de E0 da semi-reação de redução da prata tivesse sido adotado como padrão, seria correto afirmar que
* eletrodo-padrãoCaso o valor de E0 da semi-reação de redução da prata tivesse sido adotado como padrão, seria correto afirmar que- A) a produção de pilhas e baterias pela indústria seria inviabilizada.
- B) a pilha de Daniell (Zn (s) l Zn+2 (aq) ll Cu2+ (aq) l Cu (s)) seria de 1,9 V.
- C) todas as pilhas poderiam ter 0,8 V a mais do que têm hoje.
- D) apenas algumas pilhas poderiam não funcionar como funcionam hoje.
FAZER COMENTÁRIO- E) nenhuma mudança na ddp de pilhas e baterias seria notada.
A alternativa correta é letra E
Sabendo que ΔE0 só depende do valor final e inicial dos potenciais, a adoção da valor de E0 da prata com padrão não irá alterar a ddp de pilhas e baterias. A alternaiva E é a correta.Questão 36
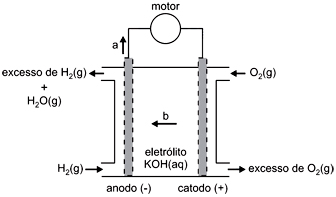 Escrevendo as equações das semirreações que ocorrem nessas pilhas de combustível, verifica-se que, nesse esquema, as setas com as letras a e b indicam, respectivamente, o sentido de movimento dosFAZER COMENTÁRIO
Escrevendo as equações das semirreações que ocorrem nessas pilhas de combustível, verifica-se que, nesse esquema, as setas com as letras a e b indicam, respectivamente, o sentido de movimento dosFAZER COMENTÁRIO- A) íons OH– e dos elétrons.
- B) elétrons e dos íons OH–.
- C) íons K+ e dos elétrons.
- D) elétrons e dos íons K+.
- E) elétrons e dos íons H+.
A alternativa correta é letra B
Para determinar as letras a e b precisamos escrever as semirreações que ocorrem nos eletrodos:Ânodo - Oxidação do HidrogênioH2 → 2H+ + 2e–Cátodo - Redução do OxigênioO2 + 4H+ → 2H2OEquação globalH2 + 1/2 O2 → H2OAssim já podemos determinar a letra a, no ânodo esta ocorrendo a oxidação do hidrogênio e a letra a representa a passagem de elétrons.Agora para determinarmos a letra b, utilizaremos o método de balanceamento em meio alcalino, adicionando OH- em ambos os lados da equação sem alterar a equação global:Ânodo - Oxidação do HidrogênioH2 + 2OH– → 2H+ + 2OH– + 2e–⇓H2 + 2OH– → 2H2O + 2e–Cátodo - Redução do OxigênioO2 + 4H+ + 4OH– + 4e– → 2H2O + 4OH–O2 + 2H2O + 4e– → 4OH–Agora balanceando o número de elétrons, escrevemos:Ânodo - Oxidação do Hidrogênio4OH- + 2H2 → 4H2O + 4e-Cátodo - Redução do OxigênioO2 + 2H2O + 4e- → 4OH-Equação globalH2 + 1/2 O2 → H2OAssim determinamos a letra b, a corrente de íons negativos esta indo da direita para a esquerda então os íons OH- negativos também vai nesse sentido: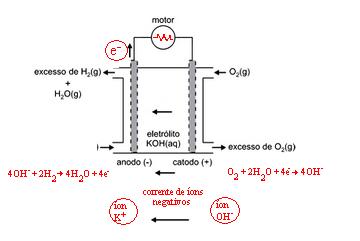
Questão 37
A figura mostra uma célula eletroquímica inventada por John Daniell em 1836. Trata-se de um sistema formado por um circuito externo capaz de conduzir a corrente elétrica e de interligar dois eletrodos que estejam separados e mergulhados num eletrólito. Uma reação química que ocorre nesse sistema interligado leva à produção de corrente elétrica.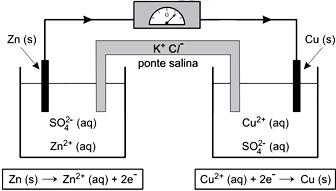 Dados:
Dados:
Zn2+(aq) + 2e– → Zn (s) E0 = – 0,76 V
Cu2+(aq) + 2e– → Cu (s) E0 = + 0,34 V
Com base nessas informações, afirma-se que:I. Nessa célula eletroquímica, a energia produzida pela reação de oxirredução espontânea é transformada em eletricidade.II. Os elétrons caminham espontaneamente, pelo fio metálico, do eletrodo de zinco para o de cobre.III. A reação de redução do Cu2+ consome elétrons e, para compensar essa diminuição de carga, os íons K+ migram para o cátodo através da ponte salina.IV. A força eletromotriz gerada por essa célula eletroquímica a 25 °C equivale a −1,1 V.É correto o que se afirma em:Com base nessas informações, afirma-se que:I. Nessa célula eletroquímica, a energia produzida pela reação de oxirredução espontânea é transformada em eletricidade.II. Os elétrons caminham espontaneamente, pelo fio metálico, do eletrodo de zinco para o de cobre.III. A reação de redução do Cu2+ consome elétrons e, para compensar essa diminuição de carga, os íons K+ migram para o cátodo através da ponte salina.IV. A força eletromotriz gerada por essa célula eletroquímica a 25 °C equivale a −1,1 V.É correto o que se afirma em:Com base nessas informações, afirma-se que:I. Nessa célula eletroquímica, a energia produzida pela reação de oxirredução espontânea é transformada em eletricidade.II. Os elétrons caminham espontaneamente, pelo fio metálico, do eletrodo de zinco para o de cobre.III. A reação de redução do Cu2+ consome elétrons e, para compensar essa diminuição de carga, os íons K+ migram para o cátodo através da ponte salina.IV. A força eletromotriz gerada por essa célula eletroquímica a 25 °C equivale a −1,1 V.É correto o que se afirma em:- A) I, II e III, apenas.
- B) I, II e IV, apenas.
- C) I, III e IV, apenas.
- D) II, III e IV, apenas.
FAZER COMENTÁRIO- E) I, II, III e IV.
A alternativa correta é letra A
A assertiva I está correta: pilhas são formadas pela reação espontânea de oxirredução que geram elétrons. A assertiva II também está correta: podemos observar que o cobre possui maior potencial de redução e, assim, irá se reduzir, ou seja, receberá elétrons; o zinco por sua vez possui um alto potencial de oxidação e irá oxidar, liberando elétrons. A assertiva III também está correta: a ponte salina tem por função manter o meio neutro em relação a cargas. E, por fim, a assertiva IV está incorreta: numa reação espontânea de oxirredução o potencial é sempre positivo. Estão coerentes as assertivas I, II e III, portanto, a resposta correta é a alternativa A.38) Em 1836, o químico John Frederic Daniell desenvolveu uma pilha, utilizando os metais cobre e zinco, para a produção de corrente elétrica. As semi-reações envolvidas são dadas por:
- A) Cu(s) | Cu2+(aq) | | Zn2+(aq) | Zn(s)
- B) Cu(s) | Zn2+(aq) | | Cu2+(aq) | Zn(s)
- C) Zn(s) | Zn2+(aq) | | Cu2+(aq) | Cu(s)
- D) Zn(s) | Cu2+(aq) | | Zn2+(aq) | Cu(s)
FAZER COMENTÁRIO- E) Zn(s) | Zn2+(aq) | | Cu(aq) | Cu2+(s)
A alternativa correta é letra C
Uma maneira de representar as pilhas eletroquímicas é atravéz de barras verticais que fazem a separação do elemento ou substância que se oxida e que rse eduz e também da ponte salina.Considerando as semi-reações de redução e oxidação mostradas no exercício, temos:Zn(s) | Zn2+(aq) | | Cu2+(aq) | Cu(s)Questão 39
aparelho utilizado para testar a condutibilidade elétrica de diferentes materiais. A lâmpada deverá acender com brilho intenso, quando osterminais T1 e T2 forem
A lâmpada deverá acender com brilho intenso, quando osterminais T1 e T2 forem- A) imersos em mercúrio líquido.
- B) imersos em água bidestilada.
- C) espetados em um pedaço de isopor.
- D) encostados em uma régua de acrílico.
FAZER COMENTÁRIO- E) espetados em um pacote com sal de cozinha.
A alternativa correta é letra A
Para que a lâmpada apresente brilho intenso, os seus terminais deverão estar imersos num meio tal que permita a condução de corrente elétrica entre os mesmos.Dentre as alternativas da questão, apenas a alternativa A representa um meio condutor de eletricidade, pois um metal no estado sólido ou líquido apresenta as condições necessárias (partículas eletrizadas livres e em quantidade suficiente) para permitir a condução de corrente elétrica.Na água bidestilada não há presença de qualquer tipo de sal, portanto, só há moléculas H2O, que não conduzem eletricidade, pois são eletricamente neutras.No isopor e no acrílico também não há partículas eletrizadas livres para a condução de eletricidade.O sal de cozinha, apesar de ser constituído por cátions (Na+) e ânions (Cl-), no estado sólido não conduz eletricidade, pois estes íons estão "aprisionados" no retículo cristalino que forma o sal sólido.Continua após a publicidade..Questão 40
 Ag = +0,80V (Ered) Cu = + 0,34V (Ered)Qual das afirmativas está errada?
Ag = +0,80V (Ered) Cu = + 0,34V (Ered)Qual das afirmativas está errada?- A) Ao se fechar o circuito, haverá um fluxo de elétrons do eletrodo de cobre para o eletrodo de prata.
- B) Ao se fechar o circuito, observará a diminuição da massa do cobre.
- C) Ao se fechar o circuito, haverá um fluxo de elétrons do eletrodo de prata para o eletrodo de cobre.
- D) O cátodo é a prata.
FAZER COMENTÁRIO- E) Ocorrera aumento da massa de prata.
« Anterior 1 2 3 4 5 6 Próximo »A alternativa correta é letra C
Observando o potencial de redução dos dois metais, nota-se que quando o circuito for fechado, a prata reduzirá, enquanto que o cobre se oxidará. Dessa forma, o cobre doará elétrons para a redução dos cátions de prata presentes na solução, sendo o fluxo de elétrons do eletrodo de cobre para o de prata. Também, haverá a perda de massa do eletrodo de cobre e aumento no de prata.Sendo assim, a resposta correta é a alternativa C. - B) Ao se fechar o circuito, observará a diminuição da massa do cobre.
- B) imersos em água bidestilada.
- B) Cu(s) | Zn2+(aq) | | Cu2+(aq) | Zn(s)
- B) I, II e IV, apenas.
- B) a pilha de Daniell (Zn (s) l Zn+2 (aq) ll Cu2+ (aq) l Cu (s)) seria de 1,9 V.
- B) 1,1 W.
- B) no eletrodo de magnésio ocorre a semi-reação
- B) dupla troca
- B) Eletrólise da água.
