Questões Sobre Eletroquímica - Química - 2º ano do ensino médio
51) Podemos dizer que, na célula eletroquímica:
- A) o magnésio sofre redução.
- B) o ferro é o ânodo.
- C) os elementos fluem, pelo circuito externo, do magnésio para o ferro.
- D) há dissolução do eletrodo de ferro.
FAZER COMENTÁRIO- E) a concentração da solução de Mg2+ diminui com o tempo.
A alternativa correta é letra C
Analisando a representação da pilha, nota-se que o magnésio sofre oxidação, o ferro se reduz. E por sofrer oxidação, a concnetração e íons Mg2+ aumenta no compartimento anódico.Também, de acordo com a norma da IUPAC quanto a representação, pode-se concluir através das duas barras, que a pilha está dividida em dois compartimentos, assim, a ligação é feita por ponte salina (entre as duas soluções) e um fio condutor entre os metais, ou seja, há passagem de íons por um circuito externo.Portanto, a resposta correta é a alternativa C.52) Nessa célula, as duas semi-reações e seus respectivos potenciais padrão de redução são os seguintes:
- A) 0,14.
- B) 0,66.
- C) 0,80.
- D) 0,94.
FAZER COMENTÁRIO- E) 1,46.
A alternativa correta é letra D
Pelos potenciais-padrão de cada semirreação, nota-se que a prata se reduzirá enquanto que o estanho se oxidará.Assim, a força eletromotriz (f.e.) da pilha formada, expresso em volts, será igual a:f.e. = +0,80 - (-0,14)f.e. = + 0,94 VPortanto, a resposta correta é a alternativa D.Questão 53
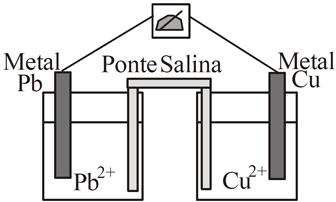 Considerando os potenciais:Pb+2 + 2e → Pb (E° = -0,13V)
Considerando os potenciais:Pb+2 + 2e → Pb (E° = -0,13V)
Cu+2 + 2e → Cu (E° = +0,34V),
Podemos afirmar corretamente sobre esta célula que:FAZER COMENTÁRIO- A) o eletrodo de chumbo é o catodo, e a ddp da pilha é -0,47V.
- B) o eletrodo de chumbo é o anodo, e a ddp da pilha é +0,47V.
- C) a transferência de elétrons se dá do cobre para o chumbo porque E°Cu > E°Pb.
- D) a ddp da pilha é +0,21V, e a oxidação ocorre no eletrodo Cu/Cu+2.
- E) a reação global espontânea da pilha é Pb+2 + Cu → Cu+2 + Pb (Δ o anodo é o E° = -0,47
A alternativa correta é letra B
Analisando as semi-reações de redução e os potenciais-padrão de cada espécie, pode-se dizer que na célula eletroquímica esquematizada, o ânodo é o eletrodo de chumbo, já que sofre oxidação; e o cátodo é o de cobre, pois sofre redução. A diferença de potencial da célula é dado abaixo:d.d.p. = E° cátodo - E° ânodod.d.p. = +0,34 - (-0,13)d.d.p. = + 0,47VPortanto, a resposta correta é a alternativa B.54) A diferença de potencial (∆E0), em volts, gerada por essa pilha é
FAZER COMENTÁRIO- A) + 0,38.
- B) –0,76.
- C) +0,76.
- D) –1,52.
- E) +1,52.
A alternativa correta é letra C
A diferença de potencial é dada pela diferença que existe entre o potencial de cada eletrodo.
Dados os potenciais de redução, subtrai-se o maior potencial de redução (da substância que será reduzida) pelo menor (da substancia que será oxidada).
Na reação entre H2 e Zn, tem-se que:
ΔE0 = E0 maior – E0 menor
ΔE0 = 0,00 V – (–0,76 V)
ΔE0 = +0,76 V55) A pilha alcalina é constituída de uma barra de manganês metálico eletroliticamente puro, imerso numa pasta de hidróxido de zinco. Dela são conhecidos os respectivos potencias-padrão de redução:
- A) + 0,42v.
- B) – 0,56v.
- C) + 1,94v.
- D) + 0,97v.
FAZER COMENTÁRIO- E) - 0,65v.
A alternativa correta é letra A
A diferença de potencial da pilha (ddp) é dado pela equação:Portanto a alternativa A é a correta.56) Na pilha de Daniell, ocorrem reações de oxidorredução com produção de energia,onde temos:
- A) oxidação no pólo negativo
- B) redução no pólo negativo
- C) pólo negativo chamado de catodo
- D) pólo positivo chamado de anodo
FAZER COMENTÁRIO- E) os elétrons caminham do pólo positivo para o negativo.
A alternativa correta é letra A
Em uma pilha, a oxidação ocorre no pólo negativo, que é chamado de ânodo. A redução ocorre no pólo positivo, que é chamado de cátodo. Os elétrons são cargas negativas e caminham do pólo negativo para o pólo positivo, por atração de partículas de cargas diferentes.Dessa forma, a alternativa A é a correta.57) Na pilha de mercúrio utilizada em relógios digitais, calculadoras e aparelhos de surdez, ocorrem reações que podem ser simplificadamente representadas por:
- A) redução do zinco.
- B) oxidação do zinco.
- C) redução da água.
- D) oxidação da água.
FAZER COMENTÁRIO- E) oxidação do mercúrio.
« Anterior 1 … 4 5 6A alternativa correta é letra B
Observando a equação química na forma iônica (segunda equação), nota-se que o Nox do zinco aumenta e do mergúrio diminui, indicando uma reação de oxirredução, em que o Zn oxida e o Hg reduz.Portanto, a resposta correta é a alternativa B. - B) oxidação do zinco.
- B) redução no pólo negativo
- B) – 0,56v.
- B) 0,66.
- B) o ferro é o ânodo.
