Questões Sobre Equação Geral dos Gases - Química - 2º ano do ensino médio
1) A quantidade total de glicose consumida pelo atleta foi de 0,5 mol. Dessa quantidade, 80% produziram somente ácido lático, e o restante foi completamente oxidado no ciclo dos ácidos tricarboxílicos.
- A) 0,10
- B) 2,24
- C) 6,72
FAZER COMENTÁRIO- D) 13,44
A alternativa correta é letra D
A equação para a reação em questão:C6H12O6 + 6O2 → 6CO2 + 6H2O
0,5 mol de C6H12O6........................... 100%
n mol de C6H12O6 ............................. 20%então n = 0,1 mol de C6H12O6
1,0 mol de C6H12O6 .......................... 6 mols de CO2
0,1 mol de C6H12O6 .......................... n mol de CO2 então n = 0,6 mol de CO2.
Nas condições normais de temperatura e pressão (CNTP), o volume é igual a 22,4L. Portanto,
1,0 mol de CO2 ............................... 22,4L de CO2
0,6 mol de CO2 ............................... V L de CO2 entãoV = 13,44L de CO2.A alternativa correta é a letra D.2) 40 L de H2 a 30ºC exercem uma pressão de 30 atm. Qual a pressão exercida pela mesma massa de gás se o seu volume dobrar e a temperatura diminuir pela metade?
- A) 0,4 atm.
- B) 1,2 atm.
- C) 0,3 atm.
- D) 0,7 atm.
FAZER COMENTÁRIO- E) 14 atm.
A alternativa correta é letra E
Ao aplicar a Lei Geral dos gases:Sendo correta a opção "E".Questão 3
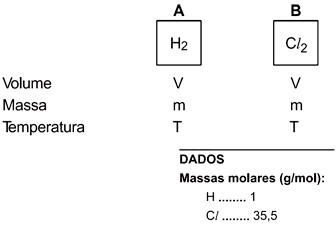 A esse respeito, são feitas as afirmações:
A esse respeito, são feitas as afirmações:
I. Em ambos os recipientes, a pressão exercida pelos gases H2 e Cl2 é a mesma.
II. No recipiente A, que contém H2, a pressão é maior do que no recipiente B, que contém Cl2.
III. Embora as massas sejam iguais, o número de partículas em A é maior do que em B.É correto o que se afirma apenas em:- A) I.
- B) I e II.
- C) III.
- D) I e III.
FAZER COMENTÁRIO- E) II e III.
A alternativa correta é letra E
Analisando as informações dadas, tem-se que:V é constante para A e B;T é constante para A e B;m é constante para A e B.Para melhor entendimento será utilizado a massa de 1g nos cálculos.Então, utilizando a equação geral dos gases: PV =nRT, onde . Tem-se que:A partir destas informações, pode-se afirmar que:I. Falso, pois a pressão exercida pelos gases H2 e Cl2 são diferentes, já que n (número de mols) não é o mesmo para ambos os gases;II. Verdadeiro, pois no recipiente A há 1 mol de H2, enquanto que no recipiente B há 0,03 mol de Cl2, ou seja, maior quantidade de matéria em A que em B, por isso a pressão exercida é maior em A;III- Verdadeiro, pois os cálculos acima afirmam esta proposição (nA> nB).Portanto, a alternativa correta é a E.Questão 4
A oxigenoterapia, tratamento terapêutico com gás oxigênio, é indicada para pacientes que apresentam falta de oxigênio no sangue, tais como portadores de doenças pulmonares. O gás oxigênio usado nesse tratamento pode ser comercializado em cilindros a elevada pressão, nas condições mostradas na figura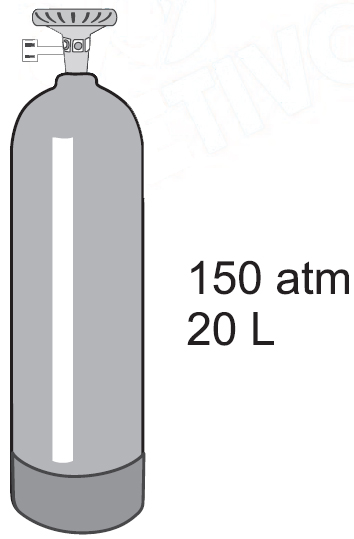 No cilindro, está indicado que o conteúdo corresponde a um volume de 3 m3 de oxigênio nas condições ambientes de pressão e temperatura, que podem ser consideradas como sendo 1 atm e 300 K, respectivamente.Dado R = 0,082 atm.L.K–1mol.–1, a massa de oxigênio, em kg, armazenada no cilindro de gás representado na figura é, aproximadamente,A oxigenoterapia, tratamento terapêutico com gás oxigênio, é indicada para pacientes que apresentam falta de oxigênio no sangue, tais como portadores de doenças pulmonares. O gás oxigênio usado nesse tratamento pode ser comercializado em cilindros a elevada pressão, nas condições mostradas na figura
No cilindro, está indicado que o conteúdo corresponde a um volume de 3 m3 de oxigênio nas condições ambientes de pressão e temperatura, que podem ser consideradas como sendo 1 atm e 300 K, respectivamente.Dado R = 0,082 atm.L.K–1mol.–1, a massa de oxigênio, em kg, armazenada no cilindro de gás representado na figura é, aproximadamente,A oxigenoterapia, tratamento terapêutico com gás oxigênio, é indicada para pacientes que apresentam falta de oxigênio no sangue, tais como portadores de doenças pulmonares. O gás oxigênio usado nesse tratamento pode ser comercializado em cilindros a elevada pressão, nas condições mostradas na figura No cilindro, está indicado que o conteúdo corresponde a um volume de 3 m3 de oxigênio nas condições ambientes de pressão e temperatura, que podem ser consideradas como sendo 1 atm e 300 K, respectivamente.Dado R = 0,082 atm.L.K–1mol.–1, a massa de oxigênio, em kg, armazenada no cilindro de gás representado na figura é, aproximadamente,A oxigenoterapia, tratamento terapêutico com gás oxigênio, é indicada para pacientes que apresentam falta de oxigênio no sangue, tais como portadores de doenças pulmonares. O gás oxigênio usado nesse tratamento pode ser comercializado em cilindros a elevada pressão, nas condições mostradas na figura
No cilindro, está indicado que o conteúdo corresponde a um volume de 3 m3 de oxigênio nas condições ambientes de pressão e temperatura, que podem ser consideradas como sendo 1 atm e 300 K, respectivamente.Dado R = 0,082 atm.L.K–1mol.–1, a massa de oxigênio, em kg, armazenada no cilindro de gás representado na figura é, aproximadamente,A oxigenoterapia, tratamento terapêutico com gás oxigênio, é indicada para pacientes que apresentam falta de oxigênio no sangue, tais como portadores de doenças pulmonares. O gás oxigênio usado nesse tratamento pode ser comercializado em cilindros a elevada pressão, nas condições mostradas na figura No cilindro, está indicado que o conteúdo corresponde a um volume de 3 m3 de oxigênio nas condições ambientes de pressão e temperatura, que podem ser consideradas como sendo 1 atm e 300 K, respectivamente.Dado R = 0,082 atm.L.K–1mol.–1, a massa de oxigênio, em kg, armazenada no cilindro de gás representado na figura é, aproximadamente,A oxigenoterapia, tratamento terapêutico com gás oxigênio, é indicada para pacientes que apresentam falta de oxigênio no sangue, tais como portadores de doenças pulmonares. O gás oxigênio usado nesse tratamento pode ser comercializado em cilindros a elevada pressão, nas condições mostradas na figura
No cilindro, está indicado que o conteúdo corresponde a um volume de 3 m3 de oxigênio nas condições ambientes de pressão e temperatura, que podem ser consideradas como sendo 1 atm e 300 K, respectivamente.Dado R = 0,082 atm.L.K–1mol.–1, a massa de oxigênio, em kg, armazenada no cilindro de gás representado na figura é, aproximadamente,A oxigenoterapia, tratamento terapêutico com gás oxigênio, é indicada para pacientes que apresentam falta de oxigênio no sangue, tais como portadores de doenças pulmonares. O gás oxigênio usado nesse tratamento pode ser comercializado em cilindros a elevada pressão, nas condições mostradas na figura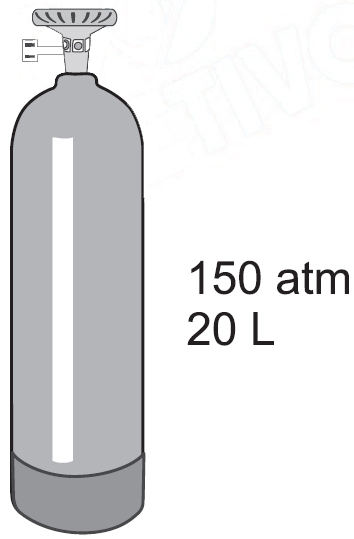 No cilindro, está indicado que o conteúdo corresponde a um volume de 3 m3 de oxigênio nas condições ambientes de pressão e temperatura, que podem ser consideradas como sendo 1 atm e 300 K, respectivamente.Dado R = 0,082 atm.L.K–1mol.–1, a massa de oxigênio, em kg, armazenada no cilindro de gás representado na figura é, aproximadamente,A oxigenoterapia, tratamento terapêutico com gás oxigênio, é indicada para pacientes que apresentam falta de oxigênio no sangue, tais como portadores de doenças pulmonares. O gás oxigênio usado nesse tratamento pode ser comercializado em cilindros a elevada pressão, nas condições mostradas na figura
No cilindro, está indicado que o conteúdo corresponde a um volume de 3 m3 de oxigênio nas condições ambientes de pressão e temperatura, que podem ser consideradas como sendo 1 atm e 300 K, respectivamente.Dado R = 0,082 atm.L.K–1mol.–1, a massa de oxigênio, em kg, armazenada no cilindro de gás representado na figura é, aproximadamente,A oxigenoterapia, tratamento terapêutico com gás oxigênio, é indicada para pacientes que apresentam falta de oxigênio no sangue, tais como portadores de doenças pulmonares. O gás oxigênio usado nesse tratamento pode ser comercializado em cilindros a elevada pressão, nas condições mostradas na figura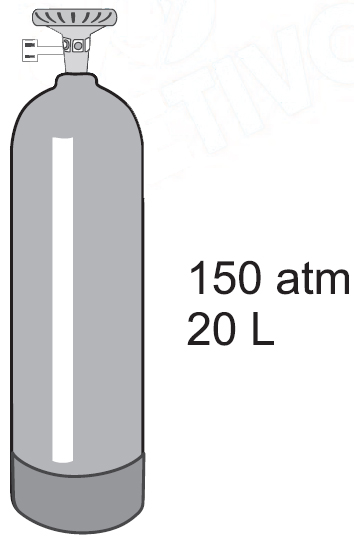 No cilindro, está indicado que o conteúdo corresponde a um volume de 3 m3 de oxigênio nas condições ambientes de pressão e temperatura, que podem ser consideradas como sendo 1 atm e 300 K, respectivamente.Dado R = 0,082 atm.L.K–1mol.–1, a massa de oxigênio, em kg, armazenada no cilindro de gás representado na figura é, aproximadamente,No cilindro, está indicado que o conteúdo corresponde a um volume de 3 m3 de oxigênio nas condições ambientes de pressão e temperatura, que podem ser consideradas como sendo 1 atm e 300 K, respectivamente.Dado R = 0,082 atm.L.K–1mol.–1, a massa de oxigênio, em kg, armazenada no cilindro de gás representado na figura é, aproximadamente,
No cilindro, está indicado que o conteúdo corresponde a um volume de 3 m3 de oxigênio nas condições ambientes de pressão e temperatura, que podem ser consideradas como sendo 1 atm e 300 K, respectivamente.Dado R = 0,082 atm.L.K–1mol.–1, a massa de oxigênio, em kg, armazenada no cilindro de gás representado na figura é, aproximadamente,No cilindro, está indicado que o conteúdo corresponde a um volume de 3 m3 de oxigênio nas condições ambientes de pressão e temperatura, que podem ser consideradas como sendo 1 atm e 300 K, respectivamente.Dado R = 0,082 atm.L.K–1mol.–1, a massa de oxigênio, em kg, armazenada no cilindro de gás representado na figura é, aproximadamente,- A) 0,98.
- B) 1,56.
- C) 1,95.
- D) 2,92.
FAZER COMENTÁRIO- E) 3,90
A alternativa correta é letra E
Da fórmula geral da lei dos gases:P.V = n.R.T1 atm. 3000 L = n . 0,082 atm.L.K-1.mol-1 . 300Kn = 121,95 mol de O21 mol de O2 ---- 32 g121,95 mol ------ xx = 3902 g = 3,90 kg5) Por meio da combustão, é possível determinar a fórmula molecular de uma substância química, o que é considerado um dos grandes avanços da química moderna. Mais de 80 milhões de substâncias já foram registradas, sendo a maioria substâncias orgânicas, o que é explicado pela capacidade do átomo de carbono de se ligar a quase todos os elementos. Em um experimento de combustão, um composto orgânico é queimado e os produtos formados, CO2 e H2O liberados, são coletados em dispositivos absorventes. Considere que a queima de 14,7 g de um composto orgânico (CxHy) gasoso puro que ocupa 8 L a 1 atm e 300 K com comportamento ideal produza aproximadamente 24 g de H2O e 44 g de CO2. Assinale a alternativa que apresenta, corretamente, a fórmula molecular desse composto orgânico.
FAZER COMENTÁRIO- A) C2H4.
- B) C2H6.
- C) C3H6.
- D) C3H8.
- E) C4H8.
A alternativa correta é letra D
Para cada 1 mol de CO2 há 1 mol de carbono (C). Então, para cada 1 mol de C temos 12 g e para 1 mol de CO2 temos 44 g. Considerando que, na questão, a queima de 14,7 g de um composto orgânico (CxHy) produza aproximadamente 44 g de CO2 pode-se determinar, estequiometricamente, a quantidade de C, conforme indicado a seguir.12 g ⇒ 44 g
X ⇒ 44 g
X = 12 g de CNo caso da água, sabe-se, pela relação estequiométrica, que para cada um mol de H2O há 2 mols de hidrogênio (H). Então, para cada 2 mols de H temos 2 g e para 1 mol de H2O temos 18 g. Considerando que na questão a queima de 14,7 g de um composto orgânico (CxHy) produza aproximadamente 24 g de H2O pode-se determinar, estequiometricamente, a quantidade de H, conforme indicado a seguir.2 g ⇒18 g
Y ⇒ 24 g
Y = 2,66 g de HEfetuando a divisão das massas de C e H obtidas da amostra pelas suas respectivas massas atômicas, obtemos a fórmula mínima do composto CxHy como sendo C1H2,66C = 12/12 = 1
H = 2,66/1 = 2,66
C1H2,66Para determinar a fórmula molecular do composto, inicialmente deve-se empregar a equação de Clapeyron (equação de gases ideais) para determinar o número de mols do composto que ocupa o volume de 8 L. De acordo com a equação e adotando as condições de temperatura e pressão descritas na questão, obtém-se o número de mols (n = 0,33 mols) do composto CxHy que ocupa o volume de 8 L.PV = nRT
n = (1 atm × 8 L)/(0,08 × 300 K)
n = 0,33 molsConhecendo o número de mols e a massa do composto (14,7 g) podemos determinar a sua massa molar (44,5 g/mol), conforme indicado a seguir.n = massa/MM
MM = 14,7 g/0,33 = 44,5 g/molSabendo a fórmula mínima (C1H2,66) e massa molar do composto, conclui-se que a fórmula molecular correta é C3H8. Portanto, a resposta correta é a alternativa D.6) Uma lata desse tipo de desodorante foi lançada em um incinerador a 25 ºC e 1 atm. Quando a temperatura do sistema atingiu 621 ºC, a lata explodiu. Considere que não houve deformação durante o aquecimento. No momento da explosão a pressão no interior da lata era
- A) 1,0 atm.
- B) 2,5 atm.
- C) 3,0 atm.
- D) 24,8 atm.
FAZER COMENTÁRIO- E) 30,0 atm.
A alternativa correta é letra C
Admitindo que não houve alteração no volume, tem-se a seguinte relação entre as condições iniciais e no momento imediatamente antes da explosão:Portanto, a resposta correta é a alternativa C.Questão 7
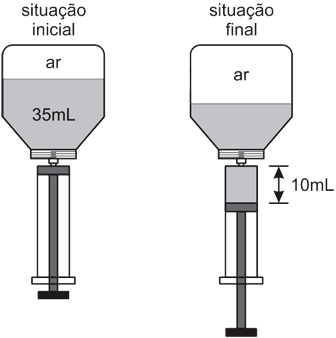 Na situação final em que a seringa com o medicamento ainda estava encaixada no frasco, a retirada dessa dose fez com que a pressão do ar dentro do frasco passasse a ser, em relação à pressão inicial,FAZER COMENTÁRIO
Na situação final em que a seringa com o medicamento ainda estava encaixada no frasco, a retirada dessa dose fez com que a pressão do ar dentro do frasco passasse a ser, em relação à pressão inicial,FAZER COMENTÁRIO- A) 60% maior
- B) 40% maior
- C) 60% menor
- D) 40% menor
- E) 25% menor
A alternativa correta é letra D
Para resolver esta questão, deve-se lembrar da equação de Clapeyron para gases ideais:Como a quantidade de gás é a mesma, tem-se o seguinte:Sabendo que V1=15 mL e V2=25 mL, já que se trata do volume de gás livre no frasco. Então, tem-se:Ou seja, P2 é equivalente a 60% de P1. Assim, a pressão final é 40% menor que a inicial. Portanto, a resposta correta é a alternativa D.Questão 8
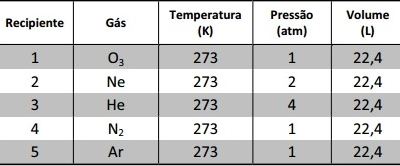 Qual recipiente contém a mesma quantidade de átomos que um recipiente selado de 22,4 L, contendo H2, mantido a 2 atm e 273 K?Qual recipiente contém a mesma quantidade de átomos que um recipiente selado de 22,4 L, contendo H2, mantido a 2 atm e 273 K?
Qual recipiente contém a mesma quantidade de átomos que um recipiente selado de 22,4 L, contendo H2, mantido a 2 atm e 273 K?Qual recipiente contém a mesma quantidade de átomos que um recipiente selado de 22,4 L, contendo H2, mantido a 2 atm e 273 K?- A) 1
- B) 2
- C) 3
- D) 4FAZER COMENTÁRIO
- E) 5
A alternativa correta é letra C
A partir da tabela fornecida podemos concluir que os volumes e as temperaturas dos cinco gases são iguais; logo, a pressão é diretamente proporcional ao número de mols dos gases:P = nEntão, para o H2, temos:1 mol de H2 − 2 × 6 × 1023
2 mols de H2 − x
x = 2,4 × 1024 átomosRepetindo o mesmo cálculo para os outros gases, chegaremos à conclusão de que o recipiente que contém a mesma quantidade de átomos que o recipiente contendo H2 é o recipiente 3, que contém Hélio (He), pois:1 mol de He − 6 × 1023
4 mols de He − yy = 2,4 × 1024 átomosPortanto, a resposta correta é a alternativa C.9) Dois tanques contendo um mesmo tipo de gás ideal, um de volume 5 L e pressão interna de 9 atm, e outro de volume 10 L e pressão interna de 6 atm, são conectados por uma válvula. Quando essa é aberta, é atingido o equilíbrio entre os dois tanques à temperatura constante. A pressão final nos tanques é
- A) 3 atm.
- B) 4 atm.
- C) 7 atm.
- D) 12 atm.
FAZER COMENTÁRIO- E) 15 atm.
A alternativa correta é letra C
Sabendo que P.V=nRT para um gás ideal, temosP1.V1=n1RT ⇔ n1=P1.V1/RTP2.V2=n2RT ⇔ n2=P2.V2/RTePT.VT=nTRT ⇔ PT.VT=(n1+n2). RTsubstituindo n1 e n2,PT.VT=(P1.V1/ RT+ P2.V2/ RT).RTcancelando os valores de RT, temos então,PT.VT= P1.V1 + P2.V2PT . (10+5) L = 9 atm . 5 L + 6 atm . 10LPT = 7 atmContinua após a publicidade..10) Nos “motores a hidrogênio” ocorrerá o processo:
- A) 60 L
- B) 35 L
- C) 5 L
- D) 40 L
FAZER COMENTÁRIO- E) 20 L
1 2 3 4 Próximo »A alternativa correta é letra E
Como os gases estão nas mesmas condições, pode-se dizer que a proporção volumétrica entre cada composto é igual a razão entre seus coeficientes estequiométricos.Assim, como o coeficiente do oxigênio é metade do hidrogênio, conclui-se que o volume de O2 necessário é de 20 L.Portanto, a resposta correta é a alternativa E. - B) 35 L
- B) 4 atm.
- B) 2,5 atm.
- B) 1,56.
- B) I e II.
- B) 1,2 atm.
- B) 2,24
