Continua após a publicidade..
Dois recipientes A e B, de igual capacidade (V) e à mesma temperatura (T), contêm a mesma massa (m) dos gases H2 e Cl2.
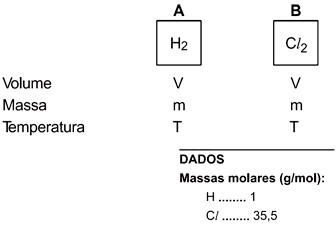
A esse respeito, são feitas as afirmações:
I. Em ambos os recipientes, a pressão exercida pelos gases H2 e Cl2 é a mesma.
II. No recipiente A, que contém H2, a pressão é maior do que no recipiente B, que contém Cl2.
III. Embora as massas sejam iguais, o número de partículas em A é maior do que em B.
I. Em ambos os recipientes, a pressão exercida pelos gases H2 e Cl2 é a mesma.
II. No recipiente A, que contém H2, a pressão é maior do que no recipiente B, que contém Cl2.
III. Embora as massas sejam iguais, o número de partículas em A é maior do que em B.
É correto o que se afirma apenas em:
- A) I.
- B) I e II.
- C) III.
- D) I e III.
- E) II e III.
Resposta:
A alternativa correta é letra E
Analisando as informações dadas, tem-se que:
V é constante para A e B;
T é constante para A e B;
m é constante para A e B.
Para melhor entendimento será utilizado a massa de 1g nos cálculos.
Então, utilizando a equação geral dos gases: PV =nRT, onde . Tem-se que:
A partir destas informações, pode-se afirmar que:
I. Falso, pois a pressão exercida pelos gases H2 e Cl2 são diferentes, já que n (número de mols) não é o mesmo para ambos os gases;
II. Verdadeiro, pois no recipiente A há 1 mol de H2, enquanto que no recipiente B há 0,03 mol de Cl2, ou seja, maior quantidade de matéria em A que em B, por isso a pressão exercida é maior em A;
III- Verdadeiro, pois os cálculos acima afirmam esta proposição (nA> nB).
Portanto, a alternativa correta é a E.

Deixe um comentário