Continua após a publicidade..
Um frasco para medicamento com capacidade de 50 mL contém 35 mL de remédio, sendo o volume restante ocupado por ar. Uma enfermeira encaixa uma seringa nesse frasco e retira 10 mL do medicamento, sem que tenha entrado ou saído ar do frasco. Considere que durante o processo a temperatura do sistema tenha permanecido constante e que o ar dentro do frasco possa ser considerado um gás ideal.
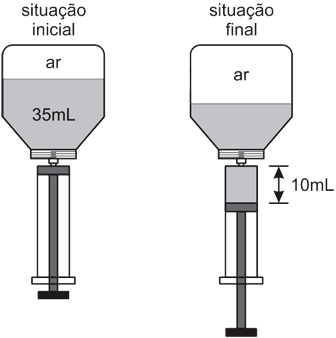
Na situação final em que a seringa com o medicamento ainda estava encaixada no frasco, a retirada dessa dose fez com que a pressão do ar dentro do frasco passasse a ser, em relação à pressão inicial,
- A) 60% maior
- B) 40% maior
- C) 60% menor
- D) 40% menor
- E) 25% menor
Resposta:
A alternativa correta é letra D
Para resolver esta questão, deve-se lembrar da equação de Clapeyron para gases ideais:
Como a quantidade de gás é a mesma, tem-se o seguinte:
Sabendo que V1=15 mL e V2=25 mL, já que se trata do volume de gás livre no frasco. Então, tem-se:
Ou seja, P2 é equivalente a 60% de P1. Assim, a pressão final é 40% menor que a inicial. Portanto, a resposta correta é a alternativa D.

Deixe um comentário