Questões Sobre Equilíbrio Químico - Química - 2º ano do ensino médio
1) Em hospitais, roupas, banheiros, pisos, etc., podem ser desinfetados com soluções aquosas de hipoclorito de sódio. Considerando que a constante de hidrólise do íon ClO−, a 25°C, é 2 x 10−7, uma solução aquosa de NaClO com pH = 10 nessa mesma temperatura tem concentração de íon hipoclorito igual a
- A) 0,01 mol/L.
- B) 0,02 mol/L.
- C) 0,05 mol/L.
- D) 0,10 mol/L.
FAZER COMENTÁRIO- E) 0,20 mol/L.
A alternativa correta é letra C
Em meio aquoso, como na solução aquosa de hipoclorito de sódio (NaClO), o íon hipoclorito ClO− sofre hidrólise. Esta reação pode ser representada pela seguinte equação:ClO− + H2O ↔HClO + OH-A partir dessa equação, podemos encontrar a expressão da constante de hidrólise:Kh =Devemos ainda considerar que as concentrações de OH- e de HClO são iguais, de acordo com a estequiometria da equação química representada. Podemos encontrar a concentração do OH-,e consequentemente do HClO, a partir do pH da solução:Pela definição de pOH, tem-se:pOH = -log [OH-]4 = -log [OH-][OH-] = [HClO] = 10-4 mol/LVoltando à expressão da constante de hidrólise, podemos substituir os valores encontrados e determinar a concentração do íon hipoclorito:Kh ==Alternativa correta, C.2) O ácido cítrico é utilizado como acidulante nos refrigerantes. Determinou-se experimentalmente que, em 5 mL de suco de limão, encontram-se 5,0.10–5mols de íons de H+, provenientes da ionização do ácido cítrico. Sendo assim, o valor do pH o suco de limão deve ser:
- A) 5
- B) 3
- C) 2
- D) 5,0.10–5
FAZER COMENTÁRIO- E) 5,0.10–6
A alternativa correta é letra C
Primeiramente, a concentração de ións H+ é de:[H+] = 5,0.10–5mols / 0,005 L[H+] = 10-2 mol/LAssim, o pH é de:pH = -log [H+]pH = - log (10-2)pH = 2Portanto, a resposta correta é a alternativa C.3) O conceito de pH foi introduzido na química pelo químico dinamarquês Soren Peter Lauritz Sorensen, em 1909, para facilitar a caracterização da acidez de uma substância. Assinale a alternativa que contém o pH da solução que se obtém ao ser feita a dissolução de 5,6 g de KOH em um litro de água. Dados: K= 39, O=16, H=1; log 1 = 0 )
- A) 1;
- B) 3;
- C) 11;
- D) 12;
FAZER COMENTÁRIO- E) 13.
A alternativa correta é letra E
A massa molecular do KOH é: 39+16+1=56. Então:56 g KOH ----- 1 mol5.6g ------- 0.1 mol KOHA dissociação de 1 mol/L de KOH produz 1 mol/L de OH-. Assim, 0.1 mol de KOH produz 0.1 mol de OH.pOH = - logpOH = - log 10-1 = 1pOH + pH = 14pH = 13, portanto, a opção correta é a "E".Questão 4
 (Disponível emhttp://josiasdesouza.folha.blog.uol.com.br/arch2007 10-01_2007-10-31.html. Acessado em 25/10/2016.)Levando em conta as informações abstraídas das figuras, depreende-se que as charges remetem a um problema recorrente de contaminação deFAZER COMENTÁRIO
(Disponível emhttp://josiasdesouza.folha.blog.uol.com.br/arch2007 10-01_2007-10-31.html. Acessado em 25/10/2016.)Levando em conta as informações abstraídas das figuras, depreende-se que as charges remetem a um problema recorrente de contaminação deFAZER COMENTÁRIO- A) leite, sendo que a figura da esquerda diz respeito ao acerto da acidez, e a da direita diz respeito à eliminação de microrganismos.
- B) leite, sendo que a figura da esquerda diz respeito à eliminação de microrganismos, e a da direita diz respeito ao acerto da acidez.
- C) dois produtos, por leite, sendo que a figura da esquerda diz respeito à contaminação de hidróxido de sódio, e a da direita diz respeito à contaminação de peróxido de hidrogênio.
- D) hidróxido de sódio, por leite, na figura da esquerda, e a figura da direita não diz respeito à contaminação de nenhum produto.
A alternativa correta é letra A
O leite em ambas as charches estão contaminados com algum tipo de produto químico, sendo que a figura da esquerda diz respeito ao acerto da acidez - hidróxido de sódio tem caráter básico- e a da direita diz respeito à eliminação de microrganismos com peróxido de hidrogênio que também tem capacidade de descolorir a fibra queratinosa.
Letra A.5) Em um recipiente são colocados 100 mL de solução 0,325M de H2SO4, 200 mL de solução a 0,150M de NaOH e 200mL de solução 0,200M de KOH. O valor do pH da solução resultante é:
- A) 4
- B) 2
- C) 10
- D) 12
FAZER COMENTÁRIO- E) 5
A alternativa correta é letra C
Para saber o pH da solução resultante, deve-se, primeiramente, encontrar a quantidade de íons H+ e OH- das soluções adicionadas e determinar a concentração final. Dessa forma, tem-se:solução de H2SO4: 2 *0,1 L *0,325 mol/L = 0,065 mol H+solução de NaOH: 1 *0,2 L *0,150 mol/L = 0,030 mol OH-solução de KOH: 1 *0,2 L * 0,200 mol/L = 0,040 mol OH-Realizando a diferença entre íons H+ e OH-, encontra-se o valor de 0,005 mol de OH-. Para determinar o pH, é necessário a concentração de OH-. A concentração é a seguinte:[OH-] = 0,005 mol / (0,1 + 0,2 + 0,2) = 0,005/0,5[OH-] = 10-4 mol/LpOH = - log [OH-]pOH = 4Assim,pH= 14 - pOHpH = 10Portanto, a resposta correta é a alternativa C.6) Sabe-se que, no estômago, o pH está na faixa de 1-3, e no intestino o pH é maior que 7. Com base nestas informações, pode-se prever que:
- A) só a aspirina é absorvida no estômago.
- B) só a anfetamina é absorvida no estômago.
- C) só a aspirina é absorvida no intestino.
- D) ambos os medicamentos são absorvidos no estômago.
FAZER COMENTÁRIO- E) ambos os medicamentos são absorvidos no intestino.
A alternativa correta é letra A
Para que os medicamentos sejam absorvidos eficientemente, eles devem estar na forma neutra. Ou seja, a aspirina (que possui a função ácido carboxílico) está na forma neutralizada em pH ácido, pois o excesso de íons H+ desloca o equílibrio no sentido da forma neutra (esquerda), portanto a aspirina é absorvida no estômago. Com a anfetamina ocorre o inverso, a alta concentração de OH- (e portanto baixa concentração de H+) do intestino faz com que prevaleça a forma neutra, pois desloca o equílibrio para a esquerda.Representando os equílibrios:Asp ⇔ Asp- + H+ (para a aspirina)Anf + H+ ⇔ Anf+ (para a anfetamina)Desse modo, a alternativa correta é A.Questão 7
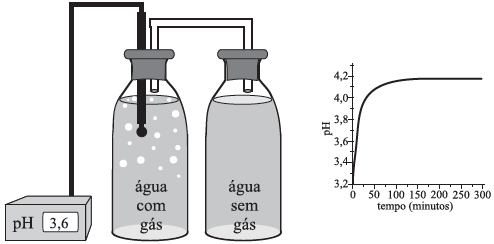 Com relação à garrafa não monitorada pelo peagâmetro, pode-se concluir que o gráfico que melhor representaria a variação de pH é:FAZER COMENTÁRIO
Com relação à garrafa não monitorada pelo peagâmetro, pode-se concluir que o gráfico que melhor representaria a variação de pH é:FAZER COMENTÁRIO- A)
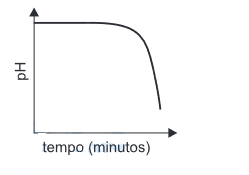
- B)
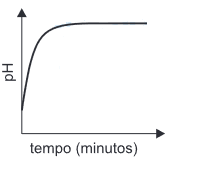
- C)
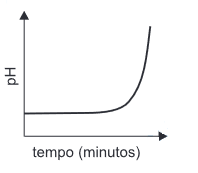
- D)
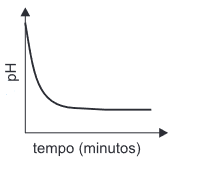
- E)
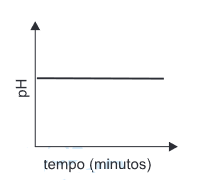
A alternativa correta é letra D
A garrafa 1 possui gás carbônico dissolvido e a garrafa 2 não possui gás algum. Quando as garrafas são ligadas, o gas sai de 1 e vai até 2. Como o gas carbônico leva a uma diminuição do pH, espera-se que a diminuição da quantidade do gás aumente o pH em 1 e aumente o pH em 2, até que seja atingido o equílibrio. Essa variação em 2 é representada pela letra D.8) O “leite de magnésia”, constituído por uma suspensão aquosa de Mg(OH)2, apresenta pH igual a 10. Isto significa que:
- A) o "leite de magnésia" tem propriedades ácidas.
- B) a concentração de íons OH- é igual a 10-10mol/L.
- C) a concentração de íons H3O+ é igual a 10-10mol/L.
- D) a concentração de íons H3O+ é igual a 1010mol/L.
FAZER COMENTÁRIO- E) a soma das concentrações dos íons H3O+e OH-é igual a 10-14mol/L.
A alternativa correta é letra C
O pH se relaciona diretamente com a concentração de íons H+ pela seguinte fórmula:pH = - log [H+]Assim, quando se tem uma solução onde o pH é 10, isso significa que a concentração de íons H+ (ou H3O+ como mostra o problema) é igual a 10-10 mol.L-1.9) O pH do leite de vaca é próximo de 7. À medida que o tempo passa, esse valor tende a diminuir devido à produção de ácido láctico por lactobacilos presentes no leite, até que o leite acabe por azedar. Para disfarçar essa deterioração natural do leite, alguns produtores desonestos o adulteravam adicionando bicarbonato de sódio. Com isso o pH do leite se elevava a um valor próximo de 9. Essa fraude pode ser descoberta, bastando para isso coletar uma amostra do leite e I. aquecer, verificando se há formação de nata. II. adicionar fenolftaleína, verificando se aparece cor rósea. III. adicionar hidróxido de sódio, verificando se ocorre efervescência. É correto o que se afirma SOMENTE em
- A) I.
- B) II.
- C) III.
- D) I e II.
FAZER COMENTÁRIO- E) II e III.
A alternativa correta é letra B
Analisando as afirmações:I) Incorreta: a formação da nata está associada a aglomeração de moléculas de gordura presentes no leite, e não ao pH;II) Correta: sendo a fenolftaleína um indicador ácido-base, podemos com o auxílio desta, identificar se uma solução é ácida ou alcalina avaliando a coloração da solução após a adição da fenolftaleína - para solução alcalinas a solução torna-se rósea;III) incorreta: o desprendimento de CO2 (efervescência) seria observado se uma solução ácida fosse adicionada.Desta forma, a alternativa correta é a B.Continua após a publicidade..10) Uma área agrícola foi adubada com amônia, nitrato e fosfato de amônio. Na amostra das águas residuais da irrigação dessa área verifica-se que a concentração de íons de OH–(aq) é igual a 8.10–5mol/L, a 25ºC. Pode-se
- A) 9,9
- B) 8,5
- C) 7,0
- D) 6,9
FAZER COMENTÁRIO- E) 3,9
1 2 3 … 11 Próximo »A alternativa correta é letra A
Primeiramente, sabe-se que o pH de uma solução equivale a:pH = 14 - pOHAssim, pOH = -log [OH-]pOH = - log (8.10–5)pOH = - ( log 8 + log 10-5)pOH = - (0,90 -5 )pOH = 4,1Com isso, o pH é de 9,9.Portanto, a reposta correta é a alternativa A. - B) 8,5
- B) II.
- B) a concentração de íons OH- é igual a 10-10mol/L.
- B) só a anfetamina é absorvida no estômago.
- B) 2
- B) 3;
- B) 3
- B) 0,02 mol/L.
