Continua após a publicidade..
A equação química, a seguir, representa uma das etapas da obtenção industrial do ácido sulfúrico.
2 SO2 + O2 ⇔ 2 SO3(g) +196kJ
Medindo-se as concentrações de cada substância desta reação em função do tempo, sob temperatura constante,
obtém-se o seguinte gráfico:
Medindo-se as concentrações de cada substância desta reação em função do tempo, sob temperatura constante,
obtém-se o seguinte gráfico:
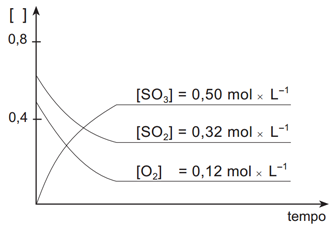
Após ter sido atingido o estado de equilíbrio, foram retiradas quatro amostras desse sistema, mantendo-se constantes as condições de equilíbrio. Cada uma dessas amostras foi submetida a uma ação diferente.
Observe, a seguir, os gráficos que representam os resultados obtidos em cada amostra.
I –
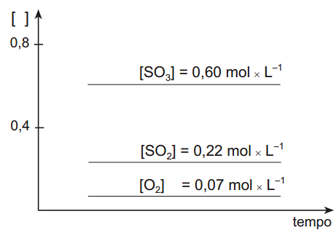
II –
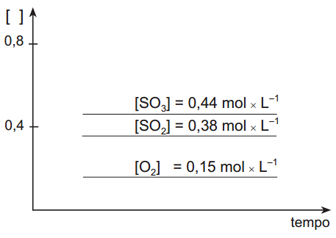
I –

II –

III –
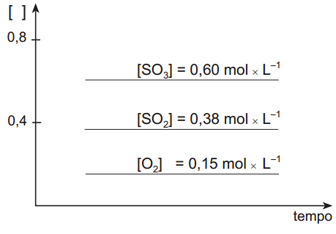
Após ter sido atingido o estado de equilíbrio, foram retiradas quatro amostras desse sistema, mantendo-se constantes as condições de equilíbrio. Cada uma dessas amostras foi submetida a uma ação diferente.
Observe, a seguir, os gráficos que representam os resultados obtidos em cada amostra.
I –
II –

I –

II –

III –

Os resultados das ações de aquecimento e de adição de catalisador estão indicados, respectivamente, pelos gráficos de números:
- A) I e III
- B) I e IV
- C) II e IV
- D)III e II
Resposta:
A alternativa correta é letra C
A questão envolve conceitos de reação endotérmica, reação exotérmica, gráfico e deslocamento de equilíbrio.
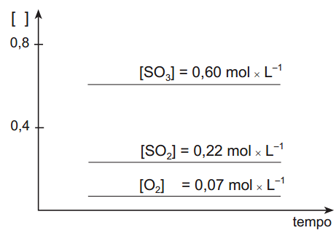
O gráfico nos mostra informação sobre a concentração dos envolvidos (eixo y) em relação ao tempo (eixo x). No nosso gráfico inicial é possível identificar que o SO3 é o produto, uma vez que sua concentração inicial é zero e vai aumentando conforme ocorre a reação até alcançar o estado de equilíbrio. Já o SO2 e o O2 são os reagentes, pois possuem uma concentração inicial diferente de zero e tal concentração vai diminuindo conforme ocorre a reação até atingir o estado de equilíbrio. Além disso, o gráfico nos informa quando a reação atinge seu estado de equilíbrio, que é o momento que a concentração fica estável e no gráfico aparece como uma linha reta. Neste caso, o exercício já nos informa a concentração no equilíbrio dos reagentes e do produto.
Em relação a uma reação exotérmica, temos um processo que ocorre com a liberação de calor (energia), por exemplo na queima de uma vela. Nesse caso, a variação da entalpia (ΔH) será sempre negativa (ΔH < 0), pois o ΔH é medido através da subtração da entalpia dos produtos pela entalpia dos reagentes (ΔH = Hprodutos – Hreagentes ou ΔH = Hfinal – Hinicial) e como ocorreu liberação de energia, a entalpia dos produtos será menor, resultando em um ΔH negativo.
Já uma reação endotérmica é um processo que ocorre com a absorção de calor (energia), como no derretimento de um gelo. Nesse caso a variação da entalpia será sempre positiva (ΔH > 0), pois a entalpia dos produtos aumenta (absorve energia) e através da subtração da entalpia dos produtos pela dos reagentes sempre será obtido um resultado positivo.
Em relação ao deslocamento de equilíbrio o exercício nos pede o que ocorrerá quando a mistura que está em equilíbrio for aquecida. Nesse caso, precisamos saber se a reação envolvida é endotérmica ou exotérmica. Pelo enunciado, sabemos que o valor do ΔH é positivo (+196kJ) e, portanto, trata-se de uma reação endotérmica. Assim, quando uma reação endotérmica em equilíbrio é aquecida irá ocorrer deslocamento de tal equilíbrio para a esquerda (reagentes). Então, ocorrerá um aumento na concentração dos reagentes e uma diminuição na concentração do produto até que seja atingido o equilíbrio novamente. Em relação ao gráfico inicial, aquele que apresenta as mudanças corretas é o gráfico II.
O exercíco também pede o que ocorrerá quando um catalisador for adicionado à mistura que está em equilíbrio. Um catalisador não altera o estado de equilíbrio de uma reação, apenas acelera o acontecimento da mesma. Assim, as concentrações tanto dos reagentes como do produto não irão alterar-se. Então, em relação ao gráfico inicial. aquele que apresenta as características corretas é o gráfico IV.
Desse modo, o exercício está finalizado, concluindo que a alternativa correta é a C (gráficos II e IV).
O gráfico nos mostra informação sobre a concentração dos envolvidos (eixo y) em relação ao tempo (eixo x). No nosso gráfico inicial é possível identificar que o SO3 é o produto, uma vez que sua concentração inicial é zero e vai aumentando conforme ocorre a reação até alcançar o estado de equilíbrio. Já o SO2 e o O2 são os reagentes, pois possuem uma concentração inicial diferente de zero e tal concentração vai diminuindo conforme ocorre a reação até atingir o estado de equilíbrio. Além disso, o gráfico nos informa quando a reação atinge seu estado de equilíbrio, que é o momento que a concentração fica estável e no gráfico aparece como uma linha reta. Neste caso, o exercício já nos informa a concentração no equilíbrio dos reagentes e do produto.
Em relação a uma reação exotérmica, temos um processo que ocorre com a liberação de calor (energia), por exemplo na queima de uma vela. Nesse caso, a variação da entalpia (ΔH) será sempre negativa (ΔH < 0), pois o ΔH é medido através da subtração da entalpia dos produtos pela entalpia dos reagentes (ΔH = Hprodutos – Hreagentes ou ΔH = Hfinal – Hinicial) e como ocorreu liberação de energia, a entalpia dos produtos será menor, resultando em um ΔH negativo.
Já uma reação endotérmica é um processo que ocorre com a absorção de calor (energia), como no derretimento de um gelo. Nesse caso a variação da entalpia será sempre positiva (ΔH > 0), pois a entalpia dos produtos aumenta (absorve energia) e através da subtração da entalpia dos produtos pela dos reagentes sempre será obtido um resultado positivo.
Em relação ao deslocamento de equilíbrio o exercício nos pede o que ocorrerá quando a mistura que está em equilíbrio for aquecida. Nesse caso, precisamos saber se a reação envolvida é endotérmica ou exotérmica. Pelo enunciado, sabemos que o valor do ΔH é positivo (+196kJ) e, portanto, trata-se de uma reação endotérmica. Assim, quando uma reação endotérmica em equilíbrio é aquecida irá ocorrer deslocamento de tal equilíbrio para a esquerda (reagentes). Então, ocorrerá um aumento na concentração dos reagentes e uma diminuição na concentração do produto até que seja atingido o equilíbrio novamente. Em relação ao gráfico inicial, aquele que apresenta as mudanças corretas é o gráfico II.
O exercíco também pede o que ocorrerá quando um catalisador for adicionado à mistura que está em equilíbrio. Um catalisador não altera o estado de equilíbrio de uma reação, apenas acelera o acontecimento da mesma. Assim, as concentrações tanto dos reagentes como do produto não irão alterar-se. Então, em relação ao gráfico inicial. aquele que apresenta as características corretas é o gráfico IV.
Desse modo, o exercício está finalizado, concluindo que a alternativa correta é a C (gráficos II e IV).

Deixe um comentário