Continua após a publicidade..
A queima de combustíveis fósseis é uma fonte de dióxido de enxofre atmosférico, assim como as erupções vulcânicas, como a que ocorreu recentemente na Islândia.
A queima de combustíveis fósseis é uma fonte de dióxido de enxofre atmosférico, assim como as erupções vulcânicas, como a que ocorreu recentemente na Islândia.
Considere ainda o equilíbrio químico, representado pela equação, que ocorre na água de uma piscina, na qual se utiliza hipoclorito em seu tratamento:
Cl2(g) + 2 OH–(aq) 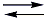 ClO–(aq) + Cl–(aq) + H2O(l)
ClO–(aq) + Cl–(aq) + H2O(l)
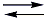 ClO–(aq) + Cl–(aq) + H2O(l)
ClO–(aq) + Cl–(aq) + H2O(l)Analise as seguintes afirmações:
I. A queima dos combustíveis carvão mineral, petróleo e álcool de cana-de-açúcar é responsável pela maioria das emissões de SO2 no planeta.
II. Acredita-se que a presença na estratosfera de partículas muito finas formadas a partir de SO2 contribua para o resfriamento da Terra, por bloquear parte da radiação solar.
III. A alteração do pH da chuva pode resultar na formação de um gás sufocante em piscinas localizadas em regiões altamente poluídas pelas emissões de SO2.
São corretas as afirmações:
- A) I e II, apenas.
- B) I e III, apenas.
- C) I, II e III.
- D) II e III, apenas.
- E) III, apenas.
Resposta:
A alternativa correta é letra D
I. A queima de carvão mineral e petróleo geram SO2, pois no carvão mineral, assim como no petróleo, estão presentes compostos de enxofre, como sulfetos e aromáticos heterocíclicos. Já a queima do etanol proveniente da cana-de-açúcar não gera SO2, pois o etanol não possui enxofre em sua composição, assim, a queima de etanol gera apenas CO2 e água, o que mostra que a afirmação I está incorreta.
II. Essas partículas de SO2 são capazes de refletir a luz do sol, que tem como principal consequência um resfriamento da terra. Assim, temos a afirmação II como Correta.
III. Sendo o SO2 um óxido ácido, quando o mesmo entra em contato com água temos um equilíbrio ácido-base, formando o ácido sulfuroso como produto, como mostrado na seguinte equação:
H2O(l) + SO2(g) 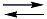 H2SO3(aq)
H2SO3(aq)
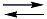 H2SO3(aq)
H2SO3(aq)O ácido sulfuro formado, em solução aquosa, sofre ionização gerando íons hidrônio H3O+ (= H+), caracterizando o que chamamos de chuva ácida, como mostrado na equação abaixo:
2 H2O(l) + H2SO3(aq) 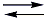 SO32-(aq) +2 H3O+(aq)
SO32-(aq) +2 H3O+(aq)
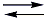 SO32-(aq) +2 H3O+(aq)
SO32-(aq) +2 H3O+(aq)Uma vez que o tratamento mais comum de piscinas é feito com hipoclorito (ClO-), resultante da dissolução de cloro (Cl2) em água, em meio alcalino, como na seguinte equação:
Cl2(g) + 2 OH–(aq) 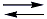 ClO–(aq) + Cl –(aq) + H2O(l)
ClO–(aq) + Cl –(aq) + H2O(l)
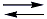 ClO–(aq) + Cl –(aq) + H2O(l)
ClO–(aq) + Cl –(aq) + H2O(l)Quando temos o fenômeno da chuva ácida, os prótons (H+), provenientes da dissolução do SO2, consomem os íons OH-, resultantes da dissolução de Cl2 em água, deslocando o equilíbrio para esquerda, ou seja, para formação de cloro gasoso (Cl2) que é um gás sufocante. Assim, a afirmação III está correta.

Deixe um comentário