Continua após a publicidade..
Certas quantidades de água comum (H2O) e de água deuterada (D2O) — água que contém átomos de eutério em lugar de átomos de hidrogênio — foram misturadas. Ocorreu a troca de átomos de hidrogênio e de eutério, formando-se moléculas de HDO e estabelecendo-se o equilíbrio (estado I) H2O + D2O → 2 HDO As quantidades, em mols, de cada composto no estado I estão indicadas pelos patamares, à esquerda, no diagrama. Depois de certo tempo, mantendo-se a temperatura constante, acrescentou-se mais água deuterada, de modo que a quantidade de D2O, no novo estado de equilíbrio (estado II), fosse o triplo daquela antes da adição. As quantidades, em mols, de cada composto envolvido no estado II estão indicadas pelos patamares, à direita, no diagrama.
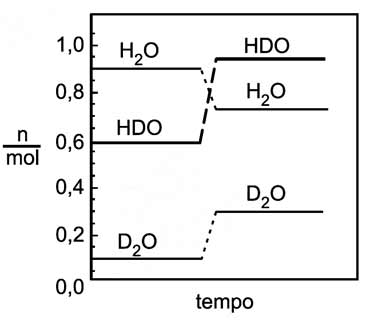
A constante de equilíbrio, nos estados I e II, tem, respectivamente, os valores
- A) 0,080 e 0,25.
- B) 4,0 e 4,0.
- C) 6,6 e 4,0.
- D) 4,0 e 12.
- E) 6,6 e 6,6.
Resposta:
A alternativa correta é letra B
A reação é: H2O + D2O 2 HDO, cuja constante de equilíbrio é :
Substituindo os valores do gráfico na equação acima:
No estado I
No estado II, a temperatura do processo se mantém constante, portanto a constante de equilíbrio é a mesma.

Deixe um comentário