Continua após a publicidade..
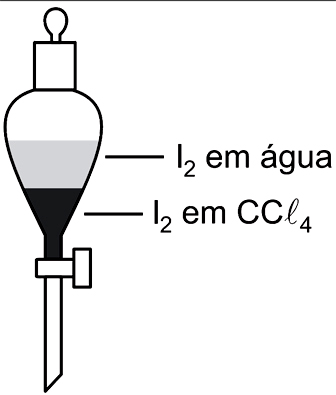
Em um funil de separação, encontram-se, em contato, volumes iguais de duas soluções: uma solução aquosa de I2, de concentração 0,1 x 10–3 mol/L, e uma solução de I2 em CCl4, de concentração 1,0 x 10–3 mol/L.
Considere que o valor da constante Kc do equilíbrio
I2(aq) ↔ I2 (CCl4)
é igual a 100, à temperatura do experimento, para concentrações expressas em mol/L.
Assim sendo, o que é correto afirmar a respeito do sistema descrito?
Assim sendo, o que é correto afirmar a respeito do sistema descrito?
- A) Se o sistema for agitado, o I2 será extraído do CCl4 pela água, até que a concentração de I2 em CCl4 se iguale a zero.
- B) Se o sistema for agitado, o I2 será extraído da água pelo CCl4, até que a concentração de I2 em água se iguale a zero.
- C) Mesmo se o sistema não for agitado, a concentração de I2 no CCl4 tenderá a aumentar e a de I2, na água, tenderá a diminuir, até que se atinja um estado de equilíbrio.
- D) Mesmo se o sistema não for agitado, a concentração de I2 na água tenderá a aumentar e a de I2, no CCl4, tenderá a diminuir, até que se atinja um estado de equilíbrio.
- E) Quer o sistema seja agitado ou não, ele já se encontra em equilíbrio e não haverá mudança nas concentrações de I2 nas duas fases.
Resposta:
A alternativa correta é letra C
Segundo as informações do texto o seguinte equilíbrio tem uma constante Kc igual a 100:
I2 (aq) ↔ I2 (CCl4) Kc = 100
Agora utilizando as concentrações molares encontradas no texto vamos calcular Q, o quociente reacional das duas soluções:
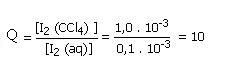
Como Q é menor do que a constante Kc significa que as suas soluções não estão em equilíbrio ainda, assim ao mistura-las o iodo (apolar) dissolvido em meio aquoso irá migrar dessa solução para o CCl4 (solvente apolar), uma vez que pela regra dos semelhantes, um composto apolar dissolve melhor em solventes apolares e vice-versa, até atingir o equilíbrio.

Deixe um comentário