Continua após a publicidade..
O gráfico abaixo correlaciona os valores da constante de equilíbrio (Kc) em função da temperatura para a reação de síntese da amônia:
N2(g) + 3 H2(g) ↔ 2 NH3(g)
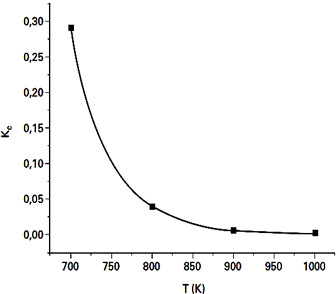
Sobre o comportamento dessa reação, no intervalo de temperatura considerado no experimento, foram feitas algumas afirmações:
I. A reação é exotérmica no sentido de formação da amônia.
II. Com o aumento da temperatura, a velocidade da reação diminui.
III. Com o aumento da temperatura, o rendimento da reação diminui, formando-se menos amônia na situação de equilíbrio.
SOMENTE está correto o que se afirma em
Sobre o comportamento dessa reação, no intervalo de temperatura considerado no experimento, foram feitas algumas afirmações:
I. A reação é exotérmica no sentido de formação da amônia.
II. Com o aumento da temperatura, a velocidade da reação diminui.
III. Com o aumento da temperatura, o rendimento da reação diminui, formando-se menos amônia na situação de equilíbrio.
SOMENTE está correto o que se afirma em
- A) I.
- B) II.
- C) III.
- D) I e II.
- E) I e III.
Resposta:
A alternativa correta é letra E
Afirmativa I: Correta
Pelo gráfico, o Kc diminui com o aumento da temperatura, assim, pode-se perceber que a reação libera calor ao invés de consumí-lo.
Afirmativa II: Errada
Não ocorre uma diminuição da velocidade da reação, occorre sim uma mudança da direção dela, que, no caso de aumento de temperatura, a reação é deslocada para a esquerda.
Afirmtiva III: Correta
Com o Kc menor, ocorre menor formação de produtos. Isso altera o rendimento da reação.

Deixe um comentário