Questões Sobre Equilíbrio Químico - Química - 2º ano do ensino médio
Questão 11
I. Em solução aquosa, ocorre o equilíbrio:

II. A ação bactericida é devida exclusivamente à forma não dissociada do ácido (BzH).
III. Quando [BzH] =[Bz–], o pH da solução é 4,2.
Com base nestas informações, e considerando a
tabela seguinte,
Alimento …………………….pH
Refrigerante………………….3,0
Picles…………………………..3,2
Leite……………………………6,5
pode-se afirmar que é possível utilizar ácido benzoico como conservante do:
II. A ação bactericida é devida exclusivamente à forma não dissociada do ácido (BzH).
III. Quando [BzH] =[Bz–], o pH da solução é 4,2.
Com base nestas informações, e considerando a
tabela seguinte,
Alimento …………………….pH
Refrigerante………………….3,0
Picles…………………………..3,2
Leite……………………………6,5
pode-se afirmar que é possível utilizar ácido benzoico como conservante do:
- A) refrigerante, apenas.
- B) leite, apenas.
- C) refrigerante e picles, apenas.
- D) refrigerante e leite, apenas.
- E) picles e leite, apenas.
FAZER COMENTÁRIOA alternativa correta é letra C
Como o pH do ácido benzóico é 4,2 e sua ação como conservante se dá apenas em sua forma protonada (BzH), para que o último ocorra é necessário que o pH do produto a ser conservado seja menor que o pH do BzH. Apenas o picles e o refrigerante, da lista acima, estão abaixo do pH do ácido.12) Os compostos cianeto de sódio (NaCN), cloreto de zinco (ZnCl2), sulfato de sódio (Na2SO4) e cloreto de amônio (NH4Cl), quando dissolvidos em água, tornam o meio, respectivamente:
- A) básico, ácido, ácido e neutro
- B) ácido, básico, neutro e ácido
- C) básico, neutro, ácido e ácido
- D) básico, ácido, neutro e ácido
FAZER COMENTÁRIO- E) ácido, neutro, básico e básico
A alternativa correta é letra D
- Cianeto de sódio (NaCN):
Em solução, há a dissociação dos íons Na+ e CN- , o CN- é originário de um ácido fraco, portanto, segue a reação de hidrólise, que resulta em um meio básico:CN- (aq) + H2O ⇔ HCN (aq) + OH- (aq)- Cloreto de Zinco (ZnCl2):
Em solução, há a dissociação dos íons Zn2+ e Cl-. Pelo fato do Zn2+ ser considerado um ácido forte, ocorre a reação de hidrólise abaixo, que resulta em um meio ácido:Zn2+ (aq) + H2O ⇔ Zn(OH)2 (aq) + H+ (aq)- Sulfato de sódio (NaSO4):
Em solução, há a formação dos íons Na+ e SO42-, que são originados de base e ácido forte, respectivamente, o que faz com que a solução resultante seja neutra.- Cloreto de amônio (NH4Cl):
Em solução, há a formação dos íons NH4+ e Cl-. O NH4+ é proveniente de uma base fraca, e portanto, sofre a seguinte reação de hidrólise, que resulta em um meio ácido:NH4+ (aq) + H2O ⇔ NH4OH (aq) + H+ (aq)Portanto, a resposta correta é a alternativa D.Questão 13
 Com base no texto e nos resultados descritos no gráfico, analise as afirmativas.
Com base no texto e nos resultados descritos no gráfico, analise as afirmativas.
I. Após 10 dias em repouso, a acidez do vinho nos frascos de 2 a 7 aumentou.
II. O comportamento do pH está associado à neutralização do ácido tartárico.
III. O carbonato de cálcio provocou redução da densidade do vinho em conseqüência da precipitação do tartarato de cálcio.
IV. A concentração molar do carbonato de cálcio, nos frascos de 2 a 7 no início do experimento, é igual à concentração em g/L multiplicada pela massa molar do carbonato de cálcio.(C=MOLARIDADE X MASSA MOLAR)
Com base no texto e nos conhecimentos sobre o tema, assinale a alternativa que contém todas as afirmativas corretas.FAZER COMENTÁRIO- A) I e III.
- B) II e III.
- C) II e IV.
- D) I, II e IV.
- E) I, III e IV.
A alternativa correta é letra B
Analisando o gráfico referente ao pH, nota-se que o pH torna-se mais básico nos frascos de 2 a 7, indicando que a acidez provocada pelo ácido tartárico é neutralizada pelo carbonato de cálcio, que é um sal básico.Em relação à densidade, nota-se uma queda, podendo ser explicada pela precipitação do tartarato de cálcio, que é um sal insolúvel.Portanto, a resposta correta é a alternativa B.Questão 14
Utilizando-se água destilada a 25°C, foram preparadas quatro soluções aquosas 0,1 mol/L. Em um béquer, os sólidos foram dissolvidos com cerca de 100 ml de água destilada, e foram medidas as temperaturas das soluções imediatamente após a dissolução. Ao atingir a temperatura de 25°C, as soluções foram transferidas para um balão volumétrico de 250 ml e o volume foi completado com água destilada. A 25°C, foi medido o pH das quatro soluções.As soluções aquosas que a 25°C apresentam pH maior que 7 são apenas as soluções de
Ao atingir a temperatura de 25°C, as soluções foram transferidas para um balão volumétrico de 250 ml e o volume foi completado com água destilada. A 25°C, foi medido o pH das quatro soluções.As soluções aquosas que a 25°C apresentam pH maior que 7 são apenas as soluções de- A) hidróxido de sódio, nitrato de potássio e sulfato de amônio.
- B) hidróxido de sódio, carbonato de sódio e sulfato de amônio.
- C) hidróxido de sódio e carbonato de sódio.
- D) nitrato de potássio e sulfato de amônio.
FAZER COMENTÁRIO- E) carbonato de sódio e sulfato de amônio.
A alternativa correta é letra C
As soluções que apresentam pH maior que 7 possuem maior caráter básico, liberando íons OH- em solução. Dessa forma, pelos compostos citados, apenas o hidróxido de sódio e o carbonato de sódio tem pH acima de 7, pelos seguintes motivos:O hidróxido de sódio é uma base forte, assim, em solução aquosa há a dissociação dos íons, liberando OH- em solução;Já o carbonato de sódio é um sal que é formado de uma base forte e ácido fraco, por isso, sofre a seguinte reação de hidrólise, liberando hidroxilas na solução:2 Na+ (aq) + CO32- (aq) +2 H2O ↔ 2 Na+ (aq) + H2CO3(aq) + 2 OH- (aq)Portanto, a resposta correta é a alternativa C.15) Em setembro de 2011, no Rio Grande do Sul, pessoas alegaram ter sofrido queimaduras depois de beberem um achocolatado. Em março de 2013, um caso semelhante voltou a ocorrer, agora com um suco de maçã. Em função de problemas semelhantes durante o processo de higienização, o achocolatado foi contaminado por água sanitária e o suco de maçã substituído por soda cáustica 2,5%. Pode-se afirmar que, comparados aos produtos não contaminados, os líquidos que causaram problemas aos consumidores apresentavam-se
- A) mais básicos e, portanto, com maiores valores de pH.
- B) mais ácidos e, portanto, com maiores valores de pH.
- C) mais ácidos e, portanto, com menores valores de pH.
FAZER COMENTÁRIO- D) mais básicos e, portanto, com menores valores de pH.
A alternativa correta é letra A
Quando a concentração de OH- é maior que a concentração de H+, temos soluções de caráter básico:
ClO– (aq) + H2O (l) ⇔ HClO (aq) + OH– (aq)NaOH (s) + H2O (l) → Na+ (aq) + OH– (aq)
Tanto a soda cáustica (NaOH), quanto a água sanitária (NaClO(aq)), possuem características básicas. Por definição, substâncias básicas possuem pH maior que 7, em uma escala que varia de 0 a 14.
Alternativa: AQuestão 16
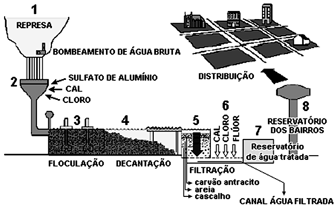 Na etapa 2, a adição de cal, nome vulgar do óxido de cálcio, tem o objetivo de corrigir o pH para aumentar a eficiência no processo de floculação das partículas em suspensão.Sobre o fenômeno que ocorre nessa etapa, é correto afirmar que a cal reage com:Na etapa 2, a adição de cal, nome vulgar do óxido de cálcio, tem o objetivo de corrigir o pH para aumentar a eficiência no processo de floculação das partículas em suspensão.Sobre o fenômeno que ocorre nessa etapa, é correto afirmar que a cal reage com:
Na etapa 2, a adição de cal, nome vulgar do óxido de cálcio, tem o objetivo de corrigir o pH para aumentar a eficiência no processo de floculação das partículas em suspensão.Sobre o fenômeno que ocorre nessa etapa, é correto afirmar que a cal reage com:Na etapa 2, a adição de cal, nome vulgar do óxido de cálcio, tem o objetivo de corrigir o pH para aumentar a eficiência no processo de floculação das partículas em suspensão.Sobre o fenômeno que ocorre nessa etapa, é correto afirmar que a cal reage com:- A) o cloreto de sódio presente na água para diminuir o pH do meio.
- B) os íons H+para aumentar o pH do meio.
- C) os íons OH-para diminuir o pH do meio.
- D) o hidróxido de sódio presente na água para aumentar o pH do meio.
FAZER COMENTÁRIO- E) a água da represa para diminuir o pH do meio.
A alternativa correta é letra B
A cal, ou óxido de cálcio, é um óxido básico, pois provêm da base hidróxido de cálcio: Ca(OH)2. Este óxido reage com os íons H+, aumentando o pH e tornando o meio mais adequado ao processo que será utilizado.Questão 17
 Para que uma amostra de 1 litro da água da fonte 1 origine uma solução aquosa com o mesmo pH da água mineral da fonte 2, a ela deverá ser acrescentada água destilada até atingir o volume de
Para que uma amostra de 1 litro da água da fonte 1 origine uma solução aquosa com o mesmo pH da água mineral da fonte 2, a ela deverá ser acrescentada água destilada até atingir o volume de- A) 2 litros.
- B) 10 litros.
- C) 20 litros.
- D) 100 litros.
FAZER COMENTÁRIO- E) 200 litros.
A alternativa correta é letra D
Sabe-se que o pH pode ser calculado pela seguinte equação: pH=-log[H+]. Logo, calculando a concentração de íons H+, tem-se:pH=4,6 ⇒ [H+]= 10-4,6 mol/LpH=6,6 ⇒ [H+]= 10-6,6 mol/LUtilizando a equação C1V1=C2V2, tem-se:C1V1=C2V2
10–4,6 mol/L x 1L = 10–6,6 mol/Lx V2
V2 = 100 LPortanto, deverá ser acrescentada 100L de água destilada até atingir o pH=6,6. Alternativa D.18) Dada uma solução 1,0 x 10-4 M de um ácido forte HX, é correto afirmar que esta solução tem:
- A) pH = 1,0 e [X-] = 10-4 M
- B) pH = 4,0 e [X-] = 1,0 M
- C) pH = 4,0 e [X-] = 10-1 M
- D) pH = 4,0 e [X-] = 10-4 M
FAZER COMENTÁRIO- E) pH = 1,0 e [X-] = 1,0 M
A alternativa correta é letra D
Dado que o ácido em questão é forte, sua ionização é completa, e obedece a seguinte reação:HX (aq) → H+ (aq) + X- (aq)Com isso, [X-] = [HX] = 10-4 ME em relação ao pH, este é dado por:pH = -log [H+]pH = - log [10-4]pH = 4Portanto, a resposta correta é a alternativa D.19) Um professor colocou vários tipos de rochas em recipientes separados, contendo o mesmo volume de solução de vinagre que, por ser ácido, foi utilizado para simular a chuva ácida e demonstrar seus possíveis efeitos. Mediu o pH da solução no início do experimento, obtendo o valor 3. Após uma semana, algumas das soluções apresentaram o mesmo pH inicial, ao passo que em outras, o pH se aproximou de 7. Qual das seguintes afirmações explica, de maneira mais satisfatória, o efeito observado?
- A) Todas as soluções poderiam, eventualmente, atingir opH 7, portanto o experimento ainda não teria se completado.
- B) O aumento do pH, em alguns casos, deve-se à reação
do vinagre com o oxigênio dissolvido na solução.- C) A composição química das rochas é variada, portanto
algumas, mas não todas, reagem com o vinagre.- D) As rochas não possuem o mesmo tamanho, portanto as reações não se processam da mesma forma.
FAZER COMENTÁRIO- E) A porosidade das rochas é diferente, tornando a reação com o vinagre mais efetiva em alguns casos.
A alternativa correta é letra C
Analisando o enunciado podemos observar que a composição das rochas não é especificada, assim, podemos inferir que a existência de rochas compostas por substâncias inertes ao ácido acético, principal constituinte do vinagre, faz com que a solução de vinagre utilizada não tenha seu pH alterado. Por outro lado, se considerarmos a exitência de rochas carbonáticas, rochas compostas por carbonatos, é fato que observaremos um aumento no valor do pH, visto que os carbonatos são sais básicos. Desta forma, a alternativa correta é a alternativa C.Continua após a publicidade..Questão 20
 FAZER COMENTÁRIO
FAZER COMENTÁRIO- A) básico, onde a [OH–] = 10–13 moI/L.
- B) básico, onde a [OH–] = 10–1 mol/L.
- C) neutro, onde a [H+] = [OH–] = 10–7 mol/L.
- D) ácido, onde a [H+] = 10–13 mol/L.
- E) ácido, onde a [H+] = 10–1 mol/L.
A alternativa correta é letra B
pH=13 (meio básico)
pH + pOH = 14
pOH = 1
pOH = -log [OH-]
[OH-] = 1 x 10-1 mol/L - B) O aumento do pH, em alguns casos, deve-se à reação
- B) pH = 4,0 e [X-] = 1,0 M
- B) 10 litros.
- B) os íons H+para aumentar o pH do meio.
- B) mais ácidos e, portanto, com maiores valores de pH.
- B) hidróxido de sódio, carbonato de sódio e sulfato de amônio.
- B) ácido, básico, neutro e ácido
- B) leite, apenas.
