Questões Sobre Equilíbrio Químico - Química - 2º ano do ensino médio
21) Comparando-se os valores de pH dos líquidos abaixo:
- A) A água do mar é mais ácida que a da chuva.
- B) O suco de limão é menos ácido de todos.
- C) O sangue é menos ácido que a saliva.
- D) A água do mar é menos básica que o sangue.
FAZER COMENTÁRIO- E) O pOH da saliva é menor que 7.
A alternativa correta é letra C
Em uma escala de pH, sabe-se que quanto menor o pH, maior é seu grau de acidez. Assim, a ordem crescente de acidez é de baixo para cima, sendo o suco de limão o mais ácido dentre as soluções apresentadas.Também, sabe-se que a soma entre pH e pOH de uma solução é igual a 14, com isso, como o pH da saliva é de 6,3, conclui-se que o seu pOH é de 7,7.Portanto, a resposta correta é a alternativa C.22) O suco gástrico é um líquido claro e transparente que contém ácido clorídrico, muco, enzimas e sais. A presença do ácido resulta em um pH entre 1,0 e 3,0, favorecendo a digestão dos alimentos. Alguns problemas de saúde alteram o seu pH, o que pode resultar em lesões no estômago. Nesses casos, para minimizar os danos ao órgão, podem ser ingeridos os denominados antiácidos, como o hidróxido de magnésio – Mg(OH)2 -, o hidróxido de alumínio – Al(OH)3 – e o bicarbonato de sódio – NaHCO3. As reações dessas substâncias com o ácido podem ser representadas pelas seguintes equações: Mg(OH)2 + 2H3O+ → Mg2+ + 4H2O NaHCO3 + H3O+ → Na+ + 2H2O + CO2 Al(OH)3 + 3H3O+ → Al3+ + 6H2O A ação dessas substâncias no controle do pH do estômago explica-se principalmente por
FAZER COMENTÁRIO- A) produzirem cátions inorgânicos em solução.
- B) liberarem grande quantidade de energia nas reações com o ácido.
- C) formarem uma película protetora contra a ação do ácido sobre a mucosa do estômago.
- D) diminuírem a concentração de H3O+ presente no suco gástrico.
- E) produzirem gases na neutralização.
A alternativa correta é letra D
O hidróxido de magnésio, [Mg(OH)2], o hidróxido de alumínio, [Al(OH)3], e o bicarbonato de sódio, [NaHCO3], apresentam como característica comum o fato de serem alcalinos, ou seja, quando ocorre a dissolução dos mesmos em água, temos a liberação do íon hidróxido (OH-). Assim, todos os compostos reagem com H3O+, presente no suco gástrico, segundo a reação abaixo:H3O+(aq) + OH-(aq)→ 2 H2O(l)Lembrando que o íon hidrônio (H3O+) é proveniente da dissolução do HCl (ácido clorídrico, presente no suco gástrico) em água e que o mesmo pode ser representado por H+. Desta forma, a alternativa correta é a que diz que as substâncias listadas diminuem a concentração de H3O+ presente no suco gástrico, ou seja, a alternativa "D".23) Do ponto de vista químico, inicialmente ocorrem a dissolução do dióxido de carbono gasoso na água e a formação de dióxido de carbono em solução. Uma vez dissolvido na água do mar, o dióxido de carbono reage rapidamente com a água, modificando seu equilíbrio iônico. Assim, a reação do dióxido de carbono com a água
- A) faz o pH da água aumentar e pode ser representada por CO2(aq) + H2O(aq) → HCO3-(aq) + H+(aq).
- B) faz o pH da água baixar e pode ser representada por CO(aq) + H2O(aq) → 2H+(aq) + CO2(aq).
- C) faz o pH da água baixar e pode ser representada por CO2(aq) + H2O(aq) → HCO3- (aq) + H+(aq).
FAZER COMENTÁRIO- D) faz o pH da água aumentar e pode ser representada por CO2(aq) + H2O(aq) → H2CO3(aq).
A alternativa correta é letra C
A dissolução do CO2(g) em água, representado pela equação I, promove a formação CO2(aq) que reage com água do mar segundo a equação II.(I) CO2(g) ↔ CO2(aq)(II) CO2(aq) + H2O(l) ↔ HCO3-(aq) + H+(aq)Portanto, a reação de CO2 com água acidifica a água reduzindo o pH , uma vez que gera íons H+. Portanto, a alternativa correta é a letra C.24) “Nuvem tóxica aterroriza Tabaí – Carreta tombou com 22,4 mil litros de ácido clorídrico, causando danos à saúde e ao ambiente.” Num dos trechos da matéria, é respondida a pergunta: O que é ácido clorídrico? Entre as características do ácido clorídrico mencionadas, encontramos: No ecossistema, a substância modifica o pH (nível de concentração de oxigênio). Há, neste caso, um erro grave em relação ao significado de pH. Visando corrigir o equívoco cometido, possivelmente por um redator pouco familiarizado com conceitos químicos, poderíamos informar-lhe que, num sistema aquoso em baixas concentrações, o pH está diretamente relacionado com:
- A) a concentração de íons OH–.
- B) a concentração de hidrogênio molecular (H2).
- C) os átomos livres de hidrogênio (
- D).
- E) a concentração de íons H+ ou H3O+. FAZER COMENTÁRIO
A alternativa correta é letra D
O pH (potencial hidrogeniônico) está diretamente relacionado com a concentração de íons H+ou H3O+ no sistema em estudo. Quanto maior a concentração de H+ menor será o pH do meio. O cálculo do pH pode ser feito por meio da seguinte expressão:pH = - log [ H+]25) Em um reservatório contendo água com pH igual a 7, houve um descarte acidental de ácido sulfúrico. Em seguida, foi adicionada uma determinada substância de caráter básico, em quantidade suficiente para neutralizar a acidez. O gráfico que representa o comportamento do pH durante esse processo é:
FAZER COMENTÁRIO- A)
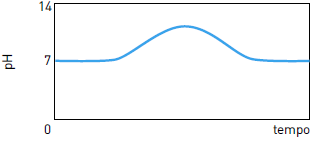
- B)

- C)
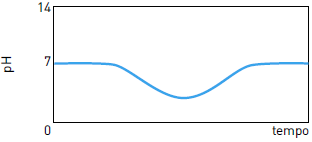
- D)
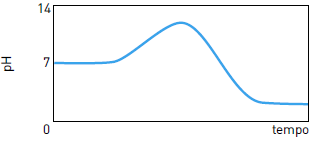
A alternativa correta é letra C
A adição de ácido acarreta a redução do pH. Como o pH inicial da água é igual a 7, com a adição do ácido, o pH passa a ter valores menores que 7.
Com a adição da base, ocorre a elevação do pH. Essa elevação se dá até a neutralização da quantidade de ácido adicionada, de forma que o pH retorna a 7.
26) O estômago produz suco gástrico constituído de ácido clorídrico, muco, enzimas e sais. O valor de pH no interior do estômago deriva, principalmente, do ácido clorídrico presente. Sendo o ácido clorídrico um ácido forte, a sua ionização é total em meio aquoso, e a concentração de H+ em quantidade de matéria nesse meio será a mesma do ácido de origem. Assim, uma solução aquosa de ácido clorídrico em concentração 0,01 mol.L-1 terá pH igual a:
- A) 2.
- B) 4.
- C) 5.
- D) 7.
FAZER COMENTÁRIO- E) 9.
A alternativa correta é letra A
Aplicando a definição de pH, determina-se o seguinte valor de pH da solução:Portanto, a resposta correta é a alternativa A.27) Um laboratório realiza a análise de células utilizando uma solução fisiológica salina com pH neutro. O laboratório dispõe de apenas quatro substâncias que poderiam ser usadas no preparo dessa solução: HCl, NaCl, NaOH e NaHCO3. Dentre elas, a que deve ser escolhida para uso na análise está indicada em:
FAZER COMENTÁRIO- A) HCl
- B) NaCl
- C) NaOH
- D) NaHCO3
A alternativa correta é letra B
O pH é utilizado para representar o grau de acidez ou basicidade de um composto. A solução que deve ser utilizada para análise é o NaCl, que é um sal e possui um pH neutro, as outras soluções são ácidos ou base, e portanto alterariam o pH. A alternativa correta é a letra B.Questão 28
Observe as curvas do gráfico abaixo: A curva que representa a tendência do que deve ter ocorrido, após o acidente, com o pH sanguíneo dos tripulantes está identificada por:
A curva que representa a tendência do que deve ter ocorrido, após o acidente, com o pH sanguíneo dos tripulantes está identificada por:- A) W
- B) X
- C) Y
FAZER COMENTÁRIO- D) Z
A alternativa correta é letra D
O transporte de gás carbônico no corpo humano ocorre através da formação do íon hidrogenocarbonato (HCO3–), formado a partir da reação:CO2(aq) + H2O(l) ⇔ H+(aq) + HCO3–(aq)Pode-se perceber que tal reação trata-se de um equilíbrio químico, sendo explicada pelo princípio de Le Chatelier. Considerando-se as informações do enunciado, com o defeito do aparelho haverá um aumento da concentração de gás carbônico no sangue, pois o mesmo é responsável pela remoção do gás carbônico do ambiente. Pelo princípio de Le Chatelier, o aumento da concentração de CO2(aq) deverá deslocar o equilíbrio da reação para a direita, no sentido de aumentar seu consumo. A consequência desse deslocamento do equilíbrio é um aumento da concentração de íons H+(aq). Por sua vez, o aumento da concentração dos íons H+(aq) causa uma diminuição do pH sanguíneo, que ficará cada vez mais ácido. A curva que melhor representa a tendência do pH sanguíneo após o acidente com o aparelho é Z. Portanto, a resposta correta é a alternativa D.29) O listrado multicor que se desenha na areia quando o nível da água baixa nas lagoas do Pantanal da Nhecolândia, conhecidas como salinas, em Mato Grosso do Sul, por muito tempo foi um mistério para observadores. A explicação está numa cianobactéria que sobrevive nas condições dessas águas de pH entre 9 e 11. Na época seca essas bactérias se reproduzem em profusão e pintam as lagoas com substâncias de sua própria decomposição.
- A) ácidas, com [H+] que varia de 10-5 a 10-3 mol/L.
- B) ácidas, com [H+] que varia de 10-2 a 10- 4 mol/L.
- C) alcalinas, com [OH-] que varia de 10-2 a 10- 4 mol/L.
- D) alcalinas, com [OH-] que varia de 10-5 a 10-3 mol/L.
FAZER COMENTÁRIO- E) neutras, com [H+] que se iguala a [OH-], de 10-7mol/L.
A alternativa correta é letra D
O pH e pOH de uma solução são determinados, respectivamente, através das seguintes equações:Dessa forma, quando é dito que o pH da solução está entre 9 e 11, indica que as águas apresentam uma concentração de H+ entre 10-9 e 10-11, ou concentração de OH- iguais a 10-5 e 10-3 (lembrando que a soma de pH e pOH é igual a 14); ou seja, uma concentração pequena de H+, sendo classificadas como soluções alcalinas.
Portanto, a resposta correta é a alternativa D.Continua após a publicidade..Questão 30
 Com base nas informações, conclui-se que:
Com base nas informações, conclui-se que:- A) o sistema com maior caráter básico apresenta [OH–] igual a 10–3,5 mol. L–1.
- B) a [OH–] no vinagre é 10–3 mol. L–1.
- C) o cafezinho e o sêmen são os únicos sistemas com caráter ácido.
- D) o sêmen é aquele que apresenta maior concentração de íons H+.
FAZER COMENTÁRIO- E) a [H+] no cafezinho é 10–9 mol. L–1.
« Anterior 1 2 3 4 5 … 11 Próximo »A alternativa correta é letra A
Sabe-se que a constante de equilíbrio da água equivale ao produto entre [OH-] e [H3O+] e seu valor é igual a 10-14.Pelos sistemas mencionados, o que apresenta o maior caráter básico é o leite de magnésia, com pH de 10,5. Com esse valor de pH, aplicando a fórmula do pH, chega-se numa concentração de [H3O+] igual a 10-10,5.Encontrada a concentração de [H3O+] e usando a constante de equilíbro da água, conclui-se que a concentração de [OH-] é de 10-3,5.Portanto, a resposta correta é a alternativa A. - B) a [OH–] no vinagre é 10–3 mol. L–1.
- B) ácidas, com [H+] que varia de 10-2 a 10- 4 mol/L.
- B) X
- B) 4.
- B) a concentração de hidrogênio molecular (H2).
- B) faz o pH da água baixar e pode ser representada por CO(aq) + H2O(aq) → 2H+(aq) + CO2(aq).
- B) O suco de limão é menos ácido de todos.
