Questões Sobre Equilíbrio Químico - Química - 2º ano do ensino médio
31) A 25°C a coca-cola apresenta pH=3. As concentrações em mol/L de H+e OH- na coca-coca são, respectivamente:
- A) 10-11 e 10-3;
- B) 10-5 e 10-9;
- C) 10-9 e 10-5;
- D) 10-3 e 10-11;
FAZER COMENTÁRIO- E) 3 e 11.
A alternativa correta é letra D
Inicialmente calculamos a concentração de H+ na coca-cola que apresenta pH=3. Para isso, valeremo-nos da relação pH=-log[H+], assim:Por definição temos que o produto das concentrações de H+ e OH- é igual 10-14, assim, podemos calcular a concentração de OH- a partir da concentração de H+. Como mostrado abaixo:Assim, a opção "D" é a correta.32) A análise de uma determinada amostra de refrigerante detectou pH = 2. A concentração de íons H+ nesse refrigerante é:
- A) 10-6 M
- B) 10-2 M
- C) 10-12 M
- D) 102 M
FAZER COMENTÁRIO- E) 10-7 M
A alternativa correta é letra B
Sabendo que a definição de pH é a seguinte, pode-se encontrar a concentração de íons H+ da seguinte forma:pH = -log [H+]10-pH = [H+] =10-2 mol/LPortanto, a resposta correta é a alternativa B.33) Na China, cientistas descobriram que tempestades de areia podem mudar o pH da água da chuva de 2.0 para 4.0, graças à presença de carbonatos em pó na areia que circula nessas tempestades. Nesse caso, a concentração hidrogeniônica na água da chuva:
- A) não se altera;
- B) passa a ser 100 vezes maior;
- C) passa a ser 2 vezes maior;
- D) passa a ser 20 vezes maior;
FAZER COMENTÁRIO- E) passa a ser 100 vezes menor;
A alternativa correta é letra E
Sabe-se que pH = - logpH = 2: = mol/LpH = 4: = mol/LAssim:portanto, opção "E".34) O estômago produz suco gástrico constituído de ácido clorídrico, muco, enzimas e sais. O valor de pH no interior do estômago deriva, principalmente, do ácido clorídrico presente. Sendo o ácido clorídrico um ácido forte, a sua ionização é total em meio aquoso, e a concentração de H+ em quantidade de matéria nesse meio será a mesma do ácido de origem. Assim, uma solução aquosa de ácido clorídrico em concentração 0,01 mol/ L terá pH igual a:
- A) 2
- B) 4
- C) 5
- D) 7
FAZER COMENTÁRIO- E) 9
A alternativa correta é letra A
Como o ácido clorídrico é um ácido forte, a concentração de íons H+ em solução será igual a concentração do ácido devido a reação de ionização.Assim, seguindo a equação de definição de pH, tem-se:pH = - log [H+]pH = - log [0,01]pH = 2Portanto, a resposta correta é a alternativa A.35) As leis de proteção ao meio ambiente proíbem que as indústrias lancem nos rios efluentes com pH menor que 5 ou superior a 8. Os efluentes das indústrias I, II e III apresentam as seguintes concentrações (em mol/L) de H+ ou OH-:Indústria Concentração no efluente (mol/L)
- A) da indústria I, somente.
- B) da indústria II, somente.
- C) da indústria III, somente.
- D) das indústrias I e II, somente.
FAZER COMENTÁRIO- E) das indústrias I, II e III.
A alternativa correta é letra C
Como é permitido lançar efluentes com pH entre 5 e 8 apenas, a indústria III não precisaria de tratamento prévio. Já a indústria I (pH 3) precisa, pois o pH dos efluentes é menor que 5; e a indústria II (pOH 5, ou seja, pH 9) possui pH maior que 8, logo, também não pode lançar os efluentes sem tratar antes.Questão 36
A tabela apresenta alguns sistemas com seus respectivos valores aproximados de pH: Com base nas informações, conclui-se que:
Com base nas informações, conclui-se que:- A) O sistema com maior caráter básico apresenta [OH–] igual a 10–3,5mol.L–1.
- B) A [OH–] no vinagre é 10–3mol.L–1.
- C) O cafezinho e o sêmen são os únicos sistemas com caráter ácido.
- D) O sêmen é aquele que apresenta maior concentração de íons H+.
FAZER COMENTÁRIO- E) A [H+] no cafezinho é 10–9mol.L–1.
A alternativa correta é letra A
Utilizando o valor da constante de autoprotonação da água, que é igual a 10-14 e pela definição de pH, pode-se concluir que:pH + pOH = 14Dessa forma, sabendo que o sistema mais básico é o leite de magnésia, com pH igual a 10,5, pode-se concluir que o valor do pOH é de 3,5. Assim, aplicando a definição de pOH ( pOH= -log [OH-] ), chega-se que a concentração de OH- na solução é de 10-3,5 mol.L-1.Portanto, a opção correta é a alternativa "A".37) Considere a equação química a seguir e assinale a alternativa que completa corretamente o texto.
- A) básico, ácido, básico, redução, elevação.
- B) básico, ácido, básico, elevação, redução.
- C) ácido, básico, ácido, elevação, redução.
- D) ácido, básico, ácido, redução, elevação.
FAZER COMENTÁRIO- E) neutro, ácido, básico, elevação, redução.
A alternativa correta é letra A
O valor de pH é o símbolo para a grandeza físico-química potencial hidrogeniônico que indica a acidez, ou alcalinidade de uma solução aquosa, indicando a quantidade de íons H+ . O pOH é relação à concentração de íons OH-. Portanto, as palavras que completariam o texto seriam respectivamente:básico, ácido, básico, redução, elevação.Portanto, a alternativa correta é a letra A.38) Bicarbonato de sódio e leite de magnésia são dois antiácidos muito utilizados. Sabendo que o leite de magnésia apresenta pH aproximadamente 10 e que é cerca de 100 vezes mais alcalino que uma certa solução de bicarbonato de sódio, pode-se afirmar que o valor do pH dessa solução de bicarbonato de sódio, nas mesmas condições de temperatura, é
- A) 14.
- B) 13.
- C) 11.
- D) 10.
FAZER COMENTÁRIO- E) 8.
A alternativa correta é letra E
Inicialmente devemos obter a concentração de OH- no leite de magnésia a partir do pH, desta forma:A seguir, sendo a alcalinidade do leite de magnésia cerca de 100 vezes maior que a da solução de bicarbonato, temos que a concentração de OH- na solução de bicarbonato é 100 x 10-4, ou seja, 10-6. Com isso, podemos agora, calcular o pH da solução de bicarbonato, como mostrado abaixo:Assim, a alternativa correta é a alternativa E.Questão 39
A tabela abaixo mostra valores aproximados de pH a 25ºC.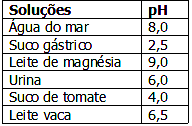 Com esses dados, é correto afirmar que:
Com esses dados, é correto afirmar que:- A) pode-se ingerir leite de magnésia para neutralizar o excesso de acidez do estômago.
- B) a água do mar “endurece” os cabelos por ser ácida.
- C) na presença de urina, a fenolftaleína muda de incolor para vermelho.
- D) o suco de tomate, por ser alcalino, é indicado no tratamento de gastrite.
FAZER COMENTÁRIO- E) o leite de vaca é uma solução básica.
A alternativa correta é letra A
As soluções com pH menor que 7 são consideradas ácidas, já as substâncias com pH maior que 7 são consideradas bases.Dentre as alternativas, a alternativa A é a correta, pois o leite de magnésia é uma base (pH = 9), capaz de neutralizar a acidez do estômago, onde está o suco gástrico (pH = 2,5).A água do mar é uma solução básica, pois tem pH maior que 7.A urina tem pH 6, ou seja, é um ácido. A fenolftaleína é um indicador que é incolor em meio ácido e vermelho em meio básico. Portanto a urina deixa a fenolftaleína incolor.O suco de tomate é ácido pois possui pH 4.O leite de vaca é uma solução um pouco ácida, quase neutra, com pH igual a 6,5.Continua após a publicidade..Questão 40
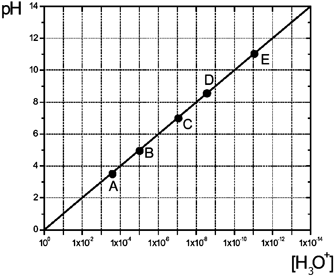 De acordo com essas informações, pode-se dizer que no gráfico ao lado, a água pura, a água do mar, o café, o leite de magnésia e o refrigerante são, respectivamente:
De acordo com essas informações, pode-se dizer que no gráfico ao lado, a água pura, a água do mar, o café, o leite de magnésia e o refrigerante são, respectivamente:- A) C, E, A, D, B;
- B) C, E, A, B, D;
- C) C, B, D, A, E;
- D) C, D, B, E, A;
FAZER COMENTÁRIO- E) A, B, C, D, E.
« Anterior 1 2 3 4 5 6 … 11 Próximo »A alternativa correta é letra D
Analisando o gráfico, nota-se que de A até E, há o aumento do pH, ou seja, a solução tende a ser mais básica quanto mais longe de A.Dessa forma, como a água é neutra, seu pH é igual a 7, sendo representada pela letra C.Com isso, conclui-se que A e B são ácidos e D e E são básicos.Como o café é menos ácido que o refrigerante, os dois líquidos são representados pela letra B e A, respectivamente. Analogamente, chega-se que o leite de magnésia e água do mar estão representados pelas letras E e D, respectivamente.Assim, tem-se:- água pura: C
- água do mar: D
- café: B
- leirte de magnésia: E
- refrigerante: A
Portanto, a resposta correta é a alternativa D. - B) C, E, A, B, D;
- B) a água do mar “endurece” os cabelos por ser ácida.
- B) 13.
- B) básico, ácido, básico, elevação, redução.
- B) A [OH–] no vinagre é 10–3mol.L–1.
- B) da indústria II, somente.
- B) 4
- B) passa a ser 100 vezes maior;
- B) 10-2 M
- B) 10-5 e 10-9;
