Questões Sobre Equilíbrio Químico - Química - 2º ano do ensino médio
Questão 41
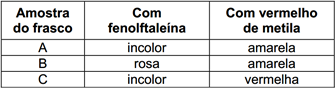
Com base nos dados apresentados na tabela, pode-se concluir que os frascos A, B e C contêm, respectivamente, as soluções de
Com base nos dados apresentados na tabela, pode-se concluir que os frascos A, B e C contêm, respectivamente, as soluções de
- A) H2SO4, NaOH e NaCl.
- B) H2SO4, NaCl e NaOH.
- C) NaOH, H2SO4 e NaCl.
- D) NaCl, H2SO4 e NaOH.
FAZER COMENTÁRIO- E) NaCl, NaOH e H2SO4.
A alternativa correta é letra E
Essa questão exige que o aluno tenha conhecimento da acidez de substâncias químicas importantes e facilmente encontradas no dia a dia. O ácido sulfúrico,H2SO4 é um ácido forte. Logo, sua solução tem pH baixo, facilmente abaixo de 5, dependendo da concentração. A adição de fenolftaleína, portanto, deve manter a solução incolor, mas a de vermelho de metila deve fazer com que a solução fique vermelha. Já o NaOH é uma base forte e sua solução apresenta pH alto, facilmente acima de 9, dependendo da concentração. Assim, a fenolftaleína deve deixar a solução rosa, mas o vermelho de metila deve mantê-la amarela. Finalmente, a solução de NaCl, sal de caráter sabidamente neutro, possui pH igual a 7. Esse valor é muito baixo para a mudança na cor da fenolftaleína, que permanece incolor; mas é muito alto para a mudança na cor do vermelho de metila, que permanece amarelo. Podemos concluir então que a solução A, é de NaCl, a solução B, de NaOH e a C, de H2SO4, a alternativa correta é a letra e.42) Jardineiros sabem que o controle do pH do solo é importante para o bom desenvolvimento das plantas. Um exemplo é a cor de alguns tipos de flores, como dálias e hortênsias, que muda de acordo com o pH do solo. As hortênsias, por exemplo, são azuladas em solo ácido e rosadas em solos neutros ou básicos. Em um jardim cujo solo apresenta pH = 5,0, um jardineiro, para obter hortênsias de cor rosa, deveria ajustar esse pH com:
- A) CaCO3
- B) H3PO4
- C) Aℓ2(SO4)3
- D) H2SO4
FAZER COMENTÁRIO- E) NH4Cl
A alternativa correta é letra A
Resolvedor - A alternativa c apresenta erro de formatação.Resolução:Para se obter hortênsias rosas, é necessário que o solo esteja básico ou neutro, dessa forma, como o solo está ácido (pH 5,0), deve-se neutralizá-lo utlizando CaCO3.Assim, ocorrerá hidrólise do íons carbonato, liberando OH- no solo, o que neutraliza o excesso de H+ presentes.Portanto, a resposta correta é a alternativa A.43) Certa solução aquosa de bicarbonato de sódio, NaHCO3,
- A) ácida e terá seu pH aumentado, se a ela for acrescentada uma porção de soda cáustica, NaOH.
- B) ácida e terá seu pH diminuído, se a ela for acrescentada uma porção de ácido clorídrico, HCl.
- C) básica e terá seu pH diminuído, se a ela for acrescentada uma porção de soda cáustica, NaOH.
- D) básica e terá seu pH diminuído, se a ela for acrescentada uma porção de ácido clorídrico, HCl.
FAZER COMENTÁRIO- E) básica e terá seu pH aumentado, se a ela for acrescentada uma porção de ácido clorídrico HCl.
A alternativa correta é letra D
A solução de bicarbonato de sódio tem caráter alcalino, pois a dissolução dos íons bicarbonato (HCO3-) em água gera íons hidróxido, como mostrado abaixo:HCO3- + H2O ↔ H2CO3 + HO-Sendo a solução básica, para neutralização da mesma é preciso adicionar um ácido, tal como o HCl.Desta forma a alternativa correta é a alternativa D.Questão 44
O caráter ácido ou básico de uma solução é determinado em função da concentração em mol/L dos íons H3O+. Sabe-se que o café e o refrigerante são ácidos; o leite de magnésia e a água do mar são básicos; e a água pura é neutra. O café é menos ácido do que o refrigerante, e o leite de magnésia é mais básico do que a água do mar.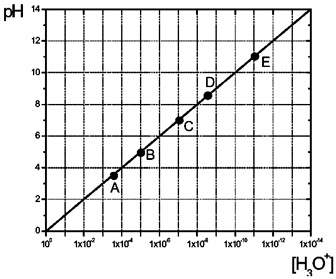 De acordo com essas informações, pode-se dizer que no gráfico ao lado, a água pura, a água do mar, o café, o leite de magnésia e o refrigerante são, respectivamente:
De acordo com essas informações, pode-se dizer que no gráfico ao lado, a água pura, a água do mar, o café, o leite de magnésia e o refrigerante são, respectivamente:- A) C, E, A, D, B;
- B) C, E, A, B, D;
- C) C, B, D, A, E;
- D) C, D, B, E, A;
FAZER COMENTÁRIO- E) A, B, C, D, E.
A alternativa correta é letra D
Uma solução ácida contém a maior quantidade de íons H3O+ e menor pH. Já uma solução básica contém uma menor quantidade de íons H3O+ e pH maior.No gráfico, o ponto E corresponde à substância mais básica, ou seja, o leite de magnésia. A solução de água do mar é básica, porém menos que o leite de magnésia, por isso é o ponto D do gráfico. Já a água pura é neutra e é representada pelo ponto C. A solução de café é o ponto B e o refrigerante, o mais ácido, o ponto A.Portanto a ordem é: C, B, D, A, E. Essa ordem corresponde à alternativa D.45) Os gases provenientes da eletrólise da água do mar foram recolhidos em um recipiente fechado de capacidade igual a 5 litros. A mistura recolhida apresentava 7,5 moles de hidrogênio e 5 moles de cloro, que reagiram de acordo com a seguinte equação:
- A) 1,0.
- B) 2,0.
- C) 2,5.
- D) 4,0.
FAZER COMENTÁRIO- E) 5,0.
A alternativa correta é letra B
Como foram formados 5 mol de HCl, foi usado 2,5 mol de Cl2 e 2,5 mol de H2 da mistura que foi recolhida. Com os dados acima em mãos, podemos calcular o Kc:46) O ácido etanoico, popularmente chamado de ácido acético, é um ácido fraco e um dos componentes do vinagre, sendo o responsável por seu sabor azedo. Dada a constante de ionização, Ka, igual a 1,8 x 10–5, assinale a alternativa que apresenta a concentração em mol . L–1 de H+ em uma solução deste ácido de concentração 2,0 x 10–2 mol . L–1.
FAZER COMENTÁRIO- A) 0,00060 mol . L–1.
- B) 0,000018 mol . L–1.
- C) 1,8 mol . L–1.
- D) 3,6 mol . L–1.
- E) 0,000060 mol . L–1.
A alternativa correta é letra A
Como o ácido acético é um ácido fraco que ioniza pouco, podemos dizer que sua concentração no equilíbrio é praticamente igual a 2,0 . 10–2 mol . L–1
1,8 . 10–5 = x . x / 2,0 . 10-2x2 = 3,6. 10-7x= 6,0 . 10–4 mol/L = 0,00060 mol . L–1.47) A isomerização catalítica de parafinas de cadeia não ramificada, produzindo seus isômeros ramificados, é um processo importante na indústria petroquímica.
- A) 10,0.
- B) 20,0.
- C) 25,0.FAZER COMENTÁRIO
- D) 40,0.
- E) 50,0.
A alternativa correta é letra E
Sabe-se, inicialmente, que a fórmula molecular dos dois compostos é dada, ambas, por C4H10, tem-se que a massa molar é igual a 58 g/mol. Também, deve-se lembrar que em reações reversíveis, a constante de equilíbrio é dada por:Sendo K= 2,5, tem-se:Utilizando a massa molar de cada um deles, e sabendo a massa inicial de n-butano era de 70,0 g, e a massa final de isobutano igual a x, chega-se no seguinte:x = 50,0 g de isobutanoPortanto, a resposta correta é a alternativa E.
48) A constante de equilíbrio Kc é igual a 10,50 para a seguinte reação, a 227°C: CO(g) + 2 H2(g) ↔ CH3OH(g) O valor de Kc para a reação abaixo, na mesma temperatura, é 2CO(g) + 4 H2(g) ↔ 2CH3OH(g)
- A) 3,25.
- B) 5,25.
- C) 10,50.
- D) 21,00.
FAZER COMENTÁRIO- E) 110,25.
A alternativa correta é letra E
Aplicando a definição de Kc para a primeira reação tem-se o seguinte:Para a segunda reação tem-se:Pode-se analisar que Kc2 = Kc12. Assim,Kc2 = 10,52Kc2= 110,25Portanto, a resposta correta é a opção "E".Questão 49
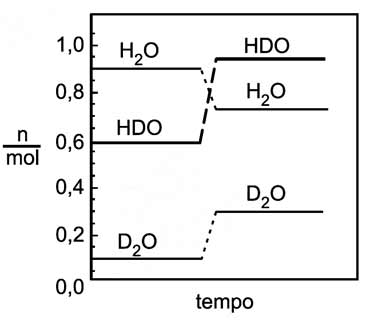 A constante de equilíbrio, nos estados I e II, tem, respectivamente, os valores
A constante de equilíbrio, nos estados I e II, tem, respectivamente, os valores- A) 0,080 e 0,25.
- B) 4,0 e 4,0.
- C) 6,6 e 4,0.
- D) 4,0 e 12.
FAZER COMENTÁRIO- E) 6,6 e 6,6.
A alternativa correta é letra B
A reação é: H2O + D2O 2 HDO, cuja constante de equilíbrio é :Substituindo os valores do gráfico na equação acima:No estado INo estado II, a temperatura do processo se mantém constante, portanto a constante de equilíbrio é a mesma.Continua após a publicidade..50) Considere uma solução aquosa diluída de ácido acético (HA), que é um ácido fraco, mantida a 25 °C. A alternativa que mostra corretamente a comparação entre as concentrações, em mol/L, das espécies químicas presentes na solução é:
FAZER COMENTÁRIO- A) [OH–] < [A–] = [H+] < [HA]
- B) [OH–] < [HA] < [A–] < [H+]
- C) [OH–] = [H+] < [HA] < [A–]
- D) [A–] < [OH–] < [H+] < [HA]
- E) [A–] < [H+] = [OH–] < [HA]
A alternativa correta é letra A
A reação de ionização do ácido acético é dada por:HA ↔ H+ + A–
ka = 1,8×10–5 mol/LNo equilíbrio temos que concentração de H+ = A–. Sabe-se que o ácido acético é um ácido fraco, ou seja, não se ioniza totalmente, logo, a concentração de íons H+ é menor que a concentração HA em solução. Além disso, a constante de ionização do ácido acético (ka) é maior que o produto iônico da água (kw), por isso a concentração de íons OH– é menor que a concentração de íons A–. Portanto, a resposta correta é a alternativa A. - B) 4,0 e 4,0.
- B) 5,25.
- B) 2,0.
- B) C, E, A, B, D;
- B) ácida e terá seu pH diminuído, se a ela for acrescentada uma porção de ácido clorídrico, HCl.
- B) H3PO4
- B) H2SO4, NaCl e NaOH.
