Questões Sobre Equilíbrio Químico - Química - 2º ano do ensino médio
51) Assinale a expressão da constante de equilíbrio em termos de concentração (KC) para a reação:
- A)
- B)
- C)
- D)
FAZER COMENTÁRIO- E)
A alternativa correta é letra D
Para o cálculo da constante de equilíbrio, apenas as substâncias no estado gasoso entram na equação.Dessa forma, a constante de equilíbrio em termos de concentração é dada a seguir:Portanto, a resposta correta é a alternativa D.Questão 52
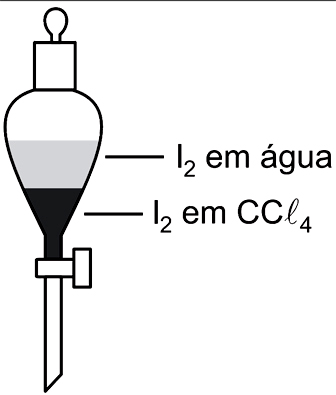 Considere que o valor da constante Kc do equilíbrioI2(aq) ↔ I2 (CCl4)é igual a 100, à temperatura do experimento, para concentrações expressas em mol/L.
Considere que o valor da constante Kc do equilíbrioI2(aq) ↔ I2 (CCl4)é igual a 100, à temperatura do experimento, para concentrações expressas em mol/L.
Assim sendo, o que é correto afirmar a respeito do sistema descrito?FAZER COMENTÁRIO- A) Se o sistema for agitado, o I2 será extraído do CCl4 pela água, até que a concentração de I2 em CCl4 se iguale a zero.
- B) Se o sistema for agitado, o I2 será extraído da água pelo CCl4, até que a concentração de I2 em água se iguale a zero.
- C) Mesmo se o sistema não for agitado, a concentração de I2 no CCl4 tenderá a aumentar e a de I2, na água, tenderá a diminuir, até que se atinja um estado de equilíbrio.
- D) Mesmo se o sistema não for agitado, a concentração de I2 na água tenderá a aumentar e a de I2, no CCl4, tenderá a diminuir, até que se atinja um estado de equilíbrio.
- E) Quer o sistema seja agitado ou não, ele já se encontra em equilíbrio e não haverá mudança nas concentrações de I2 nas duas fases.
A alternativa correta é letra C
Segundo as informações do texto o seguinte equilíbrio tem uma constante Kc igual a 100:I2 (aq) ↔ I2 (CCl4) Kc = 100Agora utilizando as concentrações molares encontradas no texto vamos calcular Q, o quociente reacional das duas soluções: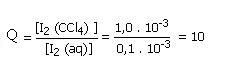 Como Q é menor do que a constante Kc significa que as suas soluções não estão em equilíbrio ainda, assim ao mistura-las o iodo (apolar) dissolvido em meio aquoso irá migrar dessa solução para o CCl4 (solvente apolar), uma vez que pela regra dos semelhantes, um composto apolar dissolve melhor em solventes apolares e vice-versa, até atingir o equilíbrio.
Como Q é menor do que a constante Kc significa que as suas soluções não estão em equilíbrio ainda, assim ao mistura-las o iodo (apolar) dissolvido em meio aquoso irá migrar dessa solução para o CCl4 (solvente apolar), uma vez que pela regra dos semelhantes, um composto apolar dissolve melhor em solventes apolares e vice-versa, até atingir o equilíbrio.Questão 53
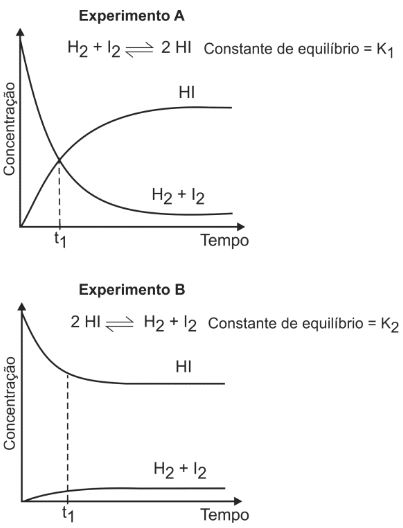 Pela análise dos dois gráficos, pode-se concluir que:FAZER COMENTÁRIO
Pela análise dos dois gráficos, pode-se concluir que:FAZER COMENTÁRIO- A) no experimento A, ocorre diminuição da pressão total no interior do recipiente, até que o equilíbrio seja atingido.
- B) no experimento B, as concentrações das substâncias (HI, H2 e I2) são iguais no instante t1.
- C) no experimento A, a velocidade de formação de HI aumenta com o tempo.
- D) no experimento B, a quantidade de matéria (em mols) de HI aumenta até que o equilíbrio seja atingido.
- E) no experimento A, o valor da constante de equilíbrio (K1) é maior do que 1.
A alternativa correta é letra E
A pressão do sistema só sofre variação se houver diminuição ou aumento do número total de mols de componentes gasosos dos produtos em relação aos reagentes. No experimento A, a pressão total do experimento permanece a mesma, uma vez que a quantidade total de mols dos reagentes é igual à quantidade de mols do produto. As concentrações das três substâncias são iguais no instante t1 apenas no experimento A. No experimento B, a concentração de HI é maior que as concentrações de H2 e I2, que são iguais. Percebe-se que, com o passar do tempo, a quantidade de HI formado diminui, ou seja, se forma menos HI com o aumento do tempo. Como a velocidade de formação de uma substância é diretamente proporcional à sua concentração, a velocidade de formação de HI diminui com o aumento do tempo. No experimento B, a curva decrescente no gráfico indica que a quantidade de matéria de HI diminui com o tempo até atingir o equilíbrio. O valor da constante de equilíbrio é dado pela equação abaixo:E como:Logo:Portanto, a resposta correta é a alternativa E.Questão 54
 A constante de equilíbrio tem o seguinte valor:FAZER COMENTÁRIO
A constante de equilíbrio tem o seguinte valor:FAZER COMENTÁRIO- A) 0,13
- B) 0,27
- C) 0,50
- D) 1,8
- E) 3,0
A alternativa correta é letra B
Pela tabela, temos que:Kc = (0,090 mol/L)2/(0,030 mol/L)Kc = 0,27Questão 55
As espécies químicas A e B reagem segundo a reação representada pela seguinte equação química: 2A + B 4C. Numa temperatura fixa, as espécies são colocadas para reagir em um recipiente com volume constante. A figura abaixo mostra como a concentração das espécies químicas A, B e C varia com o tempo.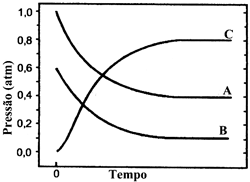 A partir da análise dessa figura, assinale a opção que apresenta o valor CORRETO da constante de equilíbrio, Kp, para esta reação.
A partir da análise dessa figura, assinale a opção que apresenta o valor CORRETO da constante de equilíbrio, Kp, para esta reação.- A) 25,6.
- B) 0,25.
- C) 4,0.
- D) 1,3.102.
FAZER COMENTÁRIO- E) 2,6.102.
A alternativa correta é letra A
Inicialmente devemos fazer uma interpolação do gráfico a partir do ponto onde temos um equilíbrio estabelecido, ou seja, a partir do ponto onde temos uma curva constante. Com isso, o btemos as pressões parciais dos produtos e reagentes, no equilíbrio:pA = 0,4 atm; pB = 0,1 atm e pC = 0,8 atmA seguir, devemos escrever a equação para constante de equilíbrio, Kp. Assim:Desta forma, a alternativa "A" é a correta.Questão 56
etanoico + etanol ⇔ etanoato de etila + águaAdmita que, nesse experimento, T= 25 ºC, P = 1 atm e KC = 4,00. Quatro amostras, retiradas aleatoriamente da mistura reacional, foram submetidas à análise para determinar a quantidade de matéria de cada uma das substâncias presentes. Os resultados em mol/L estão indicados na tabela abaixo: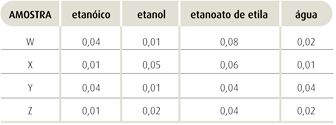
A amostra que ainda não atingiu o estado de equilíbrio é:- A) W.
- B) X.
- C) Y.
FAZER COMENTÁRIO- D) Z.
A alternativa correta é letra B
A constante de equilíbrio fornecida (Kc) é 4,0. Ou seja:
Analisando cada caso da tabela:
Logo, a única solução que não atingiu o equilíbrio é a solução X.
Alternativa B57) A maçã é apreciada pelos cantores, pois ajuda na limpeza das cordas vocais. O aroma das maçãs pode ser imitado adicionando-se acetato de etila, CH3COOCH2CH3, aos alimentos. O acetato de etila pode ser obtido a partir da reação de esterificação:
FAZER COMENTÁRIO- A) F - F - V - F - V
- B) V - V - F - F - V
- C) F - V - V - V - F
- D) V - F - F - F - V
- E) F - V - F - V - F
A alternativa correta é letra A
O equilíbrio químico ocorre quando as proporções entre reagentes e produtos numa reação química se mantêm constantes ao longo do tempo. A constante de equilíbrio, KC, pode então ser obtida a partir da relação entre as concentrações de reagentes e produtos e seus coeficientes estequiométricos. Dessa forma, para dada reação genérica:A relação para KC é dada por:[ ] indica concentração em mol/L. Aplicando-se esta relação à reação de esterificação mencionada acima, podemos analisar cada uma das proposições. A primeira afirmação é falsa. A adição de acetato de etila, um dos produtos da reação, desloca o equilíbrio para a formação dos reagentes. Desta forma, haverá um aumento da concentração dos reagentes. Como na relação para o cálculo da KC a concentração dos reagentes encontra-se no denominador, um aumento desses valores resulta na diminuição da KC. A segunda afirmação também é falsa. A adição de um catalisador numa reação química visa acelerar a formação dos produtos. O resultado seria o aumento da concentração dos produtos da reação. Consequentemente, o numerador da razão que expressa a constante de equilíbrio da reação seria maior, resultando também no aumento da KC. A terceira afirmação é verdadeira. A adição de um dos produtos, como é o caso do acetato de etila, deslocará o equilíbrio no sentido de formar reagentes até o ponto em que um novo equilíbrio é alcançado. A quarta afirmação é falsa. A adição de qualquer uma das substâncias envolvidas, reagentes ou produtos, alterará o equilíbrio no sentido de aumentar o seu consumo. Assim, a adição de ácido acético desloca o equilíbrio para o seu consumo, ou seja, para aumentar a formação dos produtos. Por fim, a quinta afirmação é verdadera. A adição de ácido acético irá resultar no aumento da concentração dos produtos na mesma proporção em que é adicionado. Desta forma, apesar de haver deslocamento do equilíbrio, as proporções entre os reagentes e produtos não se altera. Ou seja, a adição de ácido acético não deverá alterar o valor da KC. Portanto, a resposta correta é a alternativa A.Questão 58
Assinale a expressão da constante de equilíbrio em termos de concentração (Kc) para a reação:3 Fe(s) + 4 H2O (g)Fe3O4(s) + 4 H2(g)
- A)
- B)
- C)
- D)
- E) FAZER COMENTÁRIO
A alternativa correta é letra D
Para uma reação genérica abaixoAa + Bb → Cc + Dda costante de equílibrio em termos de concentração (Kc) pode ser definida pela equação:Desde que nenhum dos reagentes ou produtos sejam sólidos. Se algum reagente ou produto for sólido, ele simplesmente não entra no cálculo da constante.Na reação dada, um reagente e um produto são sólidos, portanto a equação seria:Portanto a alternativa correta é a D.59) Supondo que o sistema hipotético A ↔ B, ao atingir o equilíbrio, a dada temperatura, apresente uma quantidade de A igual ao dobro da quantidade de B, teremos uma constante de equilíbrio igual a:
- A) 1/3.
- B) 1/2.
- C) 1.
- D) 2.
FAZER COMENTÁRIO- E) 3.
A alternativa correta é letra B
Pelos dados do problema, temos:[A] = 2[B]Logo:Continua após a publicidade..Questão 60
Frutose (aq) ↔ Glicose (aq)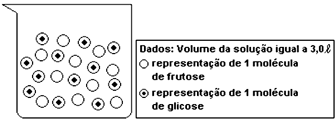
A constante de equilíbrio a 25 °C para a reação é igual a:FAZER COMENTÁRIO- A) 0,40.
- B) 0,83.
- C) 0,28.
- D) 1,20.
- E) 1,00.
A alternativa correta é letra D
Utilizando os dados da figura acima, temos: - B) 1/2.
- A) 1/3.
- B) X.
- B) 0,25.
- B)
