Questões Sobre Equilíbrio Químico - Química - 2º ano do ensino médio
Questão 61
CO2(g) + H2(g) ←→ CO(g) + H2O(g)
Foram realizados dois experimentos envolvendo esses gases em um recipiente fechado e, após atingido o equilíbrio, determinou-se a concentração de cada gás. A tabela abaixo resume os dados experimentais.
A análise desses dados permite afirmar que
A análise desses dados permite afirmar que
- A) a reação entre CO2 e H2 é um processo endotérmico.
- B) a reação entre CO2 e H2 apresenta Kc igual a 12,5 a 400ºC.
- C) a reação entre CO2 e H2 apresenta Kc igual a 2,5 a 600ºC.
- D) o Kc da reação entre CO2 e H2 independe da temperatura.
FAZER COMENTÁRIO- E) o Kc da reação entre CO2 e H2 depende do catalisador utilizado no sistema.
A alternativa correta é letra A
Pela tabela, pode-se fazer os cálculos:A 400ºCKc = 0,08A 600ºCKc = 0,4Pelos valores, há um aumento de Kc junto com uma aumento de temperatura. Logo, pode-se dizer que a reação entre CO2 e H2 é uma reação endotérmica, ou seja, ela depende da temperatura.62) Dada a equação:
- A) Kc = [SO2]2.[O2].[SO3]2
- B) Kc = [SO3]2/ [O2].[SO2]2
- C) Kc = [SO2]2.[O2] / [SO3]2
- D) Kc = 1/[SO3]2
FAZER COMENTÁRIO- E) Kc = [SO3]
A alternativa correta é letra B
A constante de equilíbrio é dada pela razão entre o produtório da concentração dos produtos pelo produtório da concentração dos reagentes (todas as concentrações elevadas ao seu respectivo coeficiente estequiométrico). Assim, ela é dada por:Kc = [SO3]2/ [O2].[SO2]2Portanto, a resposta correta é a alternativa B.63) Dada a reação X2+ 3Y2↔ 2XY3, verificou-se no equilíbrio, a 1000 °C, que as concentrações em mol/L são: [X2] = 0,20, [Y2] = 0,20, [XY3] = 0,60. O valor da constante de equilíbrio da reação química é:
- A) 2,5;
- B) 25;
- C) 175;
- D) 225;
FAZER COMENTÁRIO- E) 325;
A alternativa correta é letra D
Na reação dada:X2+ 3Y2↔ 2XY3A constante de equilíbrio será calculada por meio da seguinte expressão:Questão 64
2C5H6 C10H12 é igual a 3,0 mol–1 · L, a 250°C.Nessa temperatura, foram feitas duas misturas do monômero com o dímero, com as seguintes concentrações iniciais, expressas em mol/L:Mistura 1: [monômero] = 0,50 e [dímero] = 0,75Mistura 2: [monômero] = 1,00 e [dímero] = 2,50Representando-se:– situação de equilíbrio por
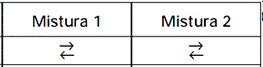
C10H12 é igual a 3,0 mol–1 · L, a 250°C.Nessa temperatura, foram feitas duas misturas do monômero com o dímero, com as seguintes concentrações iniciais, expressas em mol/L:Mistura 1: [monômero] = 0,50 e [dímero] = 0,75Mistura 2: [monômero] = 1,00 e [dímero] = 2,50Representando-se:– situação de equilíbrio por ,– tendência do equilíbrio se deslocar para a formaçãodo dímero por →,– tendência do equilíbrio se deslocar para a formação do monômero por ←, assinale a alternativa que representa a situação correta das misturas 1 e 2 no instante em que elas foram preparadas.
,– tendência do equilíbrio se deslocar para a formaçãodo dímero por →,– tendência do equilíbrio se deslocar para a formação do monômero por ←, assinale a alternativa que representa a situação correta das misturas 1 e 2 no instante em que elas foram preparadas.
- A)
- B)

- C)

- D)

- E)
 FAZER COMENTÁRIO
FAZER COMENTÁRIOA alternativa correta é letra B
A questão aborda o conceito de equílibrio químico, mais precisamente busca que se faça a análise se determinada mistura encontra-se em equilíbrio ou não. Para resolvê-la, calcularemos o quociente (Q) [C10H12]/[C5H6]2 e analisar se este é maior, menor ou igual à constante de equílibrio para prever o sentido em que a reação será deslocada ou se ela encontra-se em equílibrio.Mistura 1: Q = (0,75)/(0,5)2 = 3, 0Logo a mistura 1 encontra-se em equílibrio pois Q = Kc = 3,0 mol–1Mistura 2 : Q = (2,50)/(1,00)2 = 2,5 mol–1Logo Q< Kc, para o equílibrio ser atingido o valor de Q deve aumentar, como Q = [C10H12]/[C5H6]2, para ocorrer aumento, deve-se aumentar [C10H12] ou diminuir [C5H6], portanto, para isso, o equílibrio deve ser deslocado para a direita (→).Com isso, a resposta correta é BQuestão 65
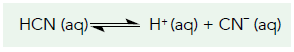 Um experimento sobre esse equilíbrio químico, realizado a temperatura constante, analisou quatro parâmetros, apresentados na tabela:
Um experimento sobre esse equilíbrio químico, realizado a temperatura constante, analisou quatro parâmetros, apresentados na tabela: Ao ser estabelecido o equilíbrio químico da ionização, foi adicionada certa quantidade de NaCN(s). Após a dissolução e dissociação completa desse composto, houve deslocamento do equilíbrio de ionização.
Ao ser estabelecido o equilíbrio químico da ionização, foi adicionada certa quantidade de NaCN(s). Após a dissolução e dissociação completa desse composto, houve deslocamento do equilíbrio de ionização.
O parâmetro que sofreu redução, após a adição do composto, é representado pelo seguinte símbolo:FAZER COMENTÁRIO- A)
- B) Ka
- C) pH
- D) [HCN]
A alternativa correta é letra A
A questão leva em conta o conhecimento do princípio de Le Chatelier, onde este diz que quando um composto é adicionado ao sistema o equilíbrio será descolado afim de consumir o novo composto, assim observando a reação: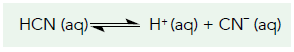 Quanto mais NaCN, mais íons CN- estarão na solução, assim o equilíbrio se deslocará no sentido contrário para o sistema entrar em equilíbrio novamente, formando mais HCN e por fim deixando o sistema com pH mais ácido e numericamente maior (lembrando que pH = – log [H+]).
Quanto mais NaCN, mais íons CN- estarão na solução, assim o equilíbrio se deslocará no sentido contrário para o sistema entrar em equilíbrio novamente, formando mais HCN e por fim deixando o sistema com pH mais ácido e numericamente maior (lembrando que pH = – log [H+]).
Já a constante de equilíbrio não sofre alteração pois só depende da variação da temperatura.
Por fim, o grau de ionização () tem relação inversamente proporcional a quantidade de moléculas de HCN no meio. Como o equilíbrio foi deslocado por razão da adição de NaCN a concentração de HCN aumentou, portanto diminuiu.
Letra A.Questão 66
A queima de combustíveis fósseis é uma fonte de dióxido de enxofre atmosférico, assim como as erupções vulcânicas, como a que ocorreu recentemente na Islândia.Considere ainda o equilíbrio químico, representado pela equação, que ocorre na água de uma piscina, na qual se utiliza hipoclorito em seu tratamento:Cl2(g) + 2 OH–(aq)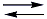 ClO–(aq) + Cl–(aq) + H2O(l)Analise as seguintes afirmações:I. A queima dos combustíveis carvão mineral, petróleo e álcool de cana-de-açúcar é responsável pela maioria das emissões de SO2 no planeta.II. Acredita-se que a presença na estratosfera de partículas muito finas formadas a partir de SO2 contribua para o resfriamento da Terra, por bloquear parte da radiação solar.III. A alteração do pH da chuva pode resultar na formação de um gás sufocante em piscinas localizadas em regiões altamente poluídas pelas emissões de SO2.São corretas as afirmações:
ClO–(aq) + Cl–(aq) + H2O(l)Analise as seguintes afirmações:I. A queima dos combustíveis carvão mineral, petróleo e álcool de cana-de-açúcar é responsável pela maioria das emissões de SO2 no planeta.II. Acredita-se que a presença na estratosfera de partículas muito finas formadas a partir de SO2 contribua para o resfriamento da Terra, por bloquear parte da radiação solar.III. A alteração do pH da chuva pode resultar na formação de um gás sufocante em piscinas localizadas em regiões altamente poluídas pelas emissões de SO2.São corretas as afirmações:- A) I e II, apenas.
- B) I e III, apenas.
- C) I, II e III.
- D) II e III, apenas.
FAZER COMENTÁRIO- E) III, apenas.
A alternativa correta é letra D
I. A queima de carvão mineral e petróleo geram SO2, pois no carvão mineral, assim como no petróleo, estão presentes compostos de enxofre, como sulfetos e aromáticos heterocíclicos. Já a queima do etanol proveniente da cana-de-açúcar não gera SO2, pois o etanol não possui enxofre em sua composição, assim, a queima de etanol gera apenas CO2 e água, o que mostra que a afirmação I está incorreta.II. Essas partículas de SO2 são capazes de refletir a luz do sol, que tem como principal consequência um resfriamento da terra. Assim, temos a afirmação II como Correta.III. Sendo o SO2 um óxido ácido, quando o mesmo entra em contato com água temos um equilíbrio ácido-base, formando o ácido sulfuroso como produto, como mostrado na seguinte equação:H2O(l) + SO2(g)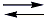 H2SO3(aq)O ácido sulfuro formado, em solução aquosa, sofre ionização gerando íons hidrônio H3O+ (= H+), caracterizando o que chamamos de chuva ácida, como mostrado na equação abaixo:2 H2O(l) + H2SO3(aq)
H2SO3(aq)O ácido sulfuro formado, em solução aquosa, sofre ionização gerando íons hidrônio H3O+ (= H+), caracterizando o que chamamos de chuva ácida, como mostrado na equação abaixo:2 H2O(l) + H2SO3(aq)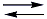 SO32-(aq) +2 H3O+(aq)Uma vez que o tratamento mais comum de piscinas é feito com hipoclorito (ClO-), resultante da dissolução de cloro (Cl2) em água, em meio alcalino, como na seguinte equação:Cl2(g) + 2 OH–(aq)
SO32-(aq) +2 H3O+(aq)Uma vez que o tratamento mais comum de piscinas é feito com hipoclorito (ClO-), resultante da dissolução de cloro (Cl2) em água, em meio alcalino, como na seguinte equação:Cl2(g) + 2 OH–(aq) ClO–(aq) + Cl –(aq) + H2O(l)Quando temos o fenômeno da chuva ácida, os prótons (H+), provenientes da dissolução do SO2, consomem os íons OH-, resultantes da dissolução de Cl2 em água, deslocando o equilíbrio para esquerda, ou seja, para formação de cloro gasoso (Cl2) que é um gás sufocante. Assim, a afirmação III está correta.
ClO–(aq) + Cl –(aq) + H2O(l)Quando temos o fenômeno da chuva ácida, os prótons (H+), provenientes da dissolução do SO2, consomem os íons OH-, resultantes da dissolução de Cl2 em água, deslocando o equilíbrio para esquerda, ou seja, para formação de cloro gasoso (Cl2) que é um gás sufocante. Assim, a afirmação III está correta.Questão 67
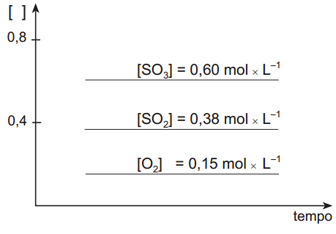
2 SO2 + O2 ⇔ 2 SO3(g) +196kJMedindo-se as concentrações de cada substância desta reação em função do tempo, sob temperatura constante,obtém-se o seguinte gráfico:Medindo-se as concentrações de cada substância desta reação em função do tempo, sob temperatura constante,obtém-se o seguinte gráfico: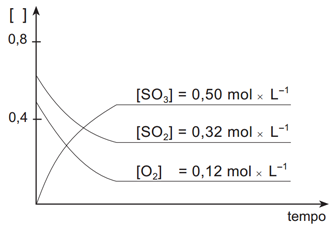 Após ter sido atingido o estado de equilíbrio, foram retiradas quatro amostras desse sistema, mantendo-se constantes as condições de equilíbrio. Cada uma dessas amostras foi submetida a uma ação diferente.Observe, a seguir, os gráficos que representam os resultados obtidos em cada amostra.
Após ter sido atingido o estado de equilíbrio, foram retiradas quatro amostras desse sistema, mantendo-se constantes as condições de equilíbrio. Cada uma dessas amostras foi submetida a uma ação diferente.Observe, a seguir, os gráficos que representam os resultados obtidos em cada amostra.
I –
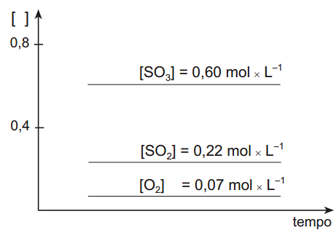
II –
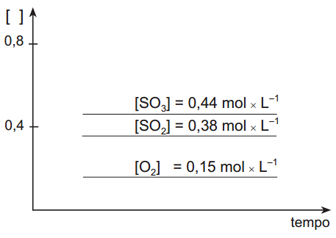
III –
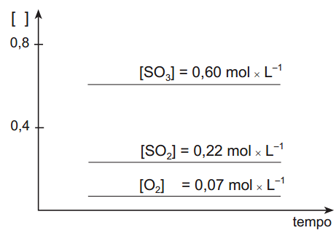
 Após ter sido atingido o estado de equilíbrio, foram retiradas quatro amostras desse sistema, mantendo-se constantes as condições de equilíbrio. Cada uma dessas amostras foi submetida a uma ação diferente.Observe, a seguir, os gráficos que representam os resultados obtidos em cada amostra.
Após ter sido atingido o estado de equilíbrio, foram retiradas quatro amostras desse sistema, mantendo-se constantes as condições de equilíbrio. Cada uma dessas amostras foi submetida a uma ação diferente.Observe, a seguir, os gráficos que representam os resultados obtidos em cada amostra.
I –
II –

III –
 Os resultados das ações de aquecimento e de adição de catalisador estão indicados, respectivamente, pelos gráficos de números:
Os resultados das ações de aquecimento e de adição de catalisador estão indicados, respectivamente, pelos gráficos de números:- A) I e III
- B) I e IV
- C) II e IV
FAZER COMENTÁRIO- D)III e II
A alternativa correta é letra C
A questão envolve conceitos de reação endotérmica, reação exotérmica, gráfico e deslocamento de equilíbrio.
O gráfico nos mostra informação sobre a concentração dos envolvidos (eixo y) em relação ao tempo (eixo x). No nosso gráfico inicial é possível identificar que o SO3 é o produto, uma vez que sua concentração inicial é zero e vai aumentando conforme ocorre a reação até alcançar o estado de equilíbrio. Já o SO2 e o O2 são os reagentes, pois possuem uma concentração inicial diferente de zero e tal concentração vai diminuindo conforme ocorre a reação até atingir o estado de equilíbrio. Além disso, o gráfico nos informa quando a reação atinge seu estado de equilíbrio, que é o momento que a concentração fica estável e no gráfico aparece como uma linha reta. Neste caso, o exercício já nos informa a concentração no equilíbrio dos reagentes e do produto.
Em relação a uma reação exotérmica, temos um processo que ocorre com a liberação de calor (energia), por exemplo na queima de uma vela. Nesse caso, a variação da entalpia (ΔH) será sempre negativa (ΔH < 0), pois o ΔH é medido através da subtração da entalpia dos produtos pela entalpia dos reagentes (ΔH = Hprodutos – Hreagentes ou ΔH = Hfinal – Hinicial) e como ocorreu liberação de energia, a entalpia dos produtos será menor, resultando em um ΔH negativo.
Já uma reação endotérmica é um processo que ocorre com a absorção de calor (energia), como no derretimento de um gelo. Nesse caso a variação da entalpia será sempre positiva (ΔH > 0), pois a entalpia dos produtos aumenta (absorve energia) e através da subtração da entalpia dos produtos pela dos reagentes sempre será obtido um resultado positivo.
Em relação ao deslocamento de equilíbrio o exercício nos pede o que ocorrerá quando a mistura que está em equilíbrio for aquecida. Nesse caso, precisamos saber se a reação envolvida é endotérmica ou exotérmica. Pelo enunciado, sabemos que o valor do ΔH é positivo (+196kJ) e, portanto, trata-se de uma reação endotérmica. Assim, quando uma reação endotérmica em equilíbrio é aquecida irá ocorrer deslocamento de tal equilíbrio para a esquerda (reagentes). Então, ocorrerá um aumento na concentração dos reagentes e uma diminuição na concentração do produto até que seja atingido o equilíbrio novamente. Em relação ao gráfico inicial, aquele que apresenta as mudanças corretas é o gráfico II.
O exercíco também pede o que ocorrerá quando um catalisador for adicionado à mistura que está em equilíbrio. Um catalisador não altera o estado de equilíbrio de uma reação, apenas acelera o acontecimento da mesma. Assim, as concentrações tanto dos reagentes como do produto não irão alterar-se. Então, em relação ao gráfico inicial. aquele que apresenta as características corretas é o gráfico IV.
Desse modo, o exercício está finalizado, concluindo que a alternativa correta é a C (gráficos II e IV).68) Para o sistema em equilíbrio, representado abaixo, sabe-se que o sentido direto (para a direit
FAZER COMENTÁRIO- A) é o exotérmico e o sentido inverso (para a esquerd
A alternativa correta é letra C
A diminuição de pressão em um sistema, desloca a reação para a direção onde há a formação de produtos com maior número de mols. Na reação em questão, a reação se desloca para a esquerda. Quando ocorre uma diminuição de temperatura, a reação é deslocada para o lado onde acontece absorção de calor para restabelecer o equilíbrio. No caso, vai se deslocar no sentido da reação endotérmica.69) Considere um sistema fechado que contém inicialmente apenas os reagentes A e B. Essas substâncias podem reagir entre si formando dois produtos diferentes:
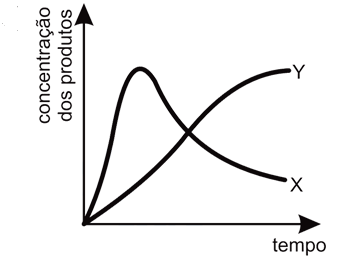
FAZER COMENTÁRIO- A)
- B)
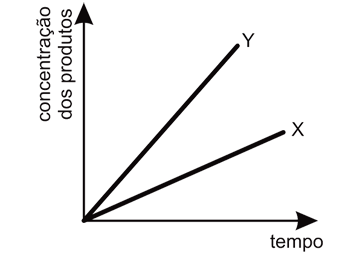
- C)
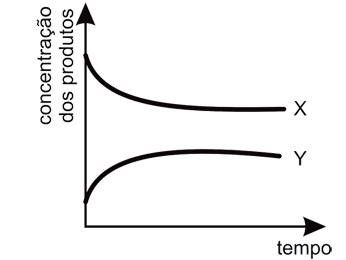
- D)
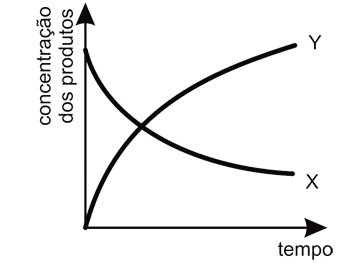
- E)
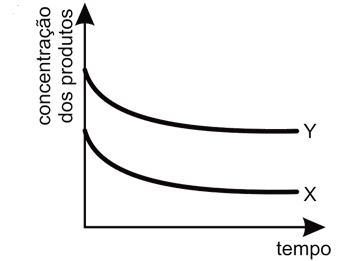
A alternativa correta é letra A
Ápos o sistema atingir o equilíbrio, essa variação poderá ser representada pelo gráfica como o da letra A, pois segundo as informações contidas no enunciado da questão, diz que a rapidez da reação 1 é muito maior que a rapidez da reação 2. Logo, no início da reação, há maior concentração do produto X. Entretanto, pelos valores de constante de equílibrio, nota-se que a substância Y é mais estável e portanto, com o passar do tempo, esta substância terá maior concentração que a substância X, pois esta última será consumida para formar os reagentes de partida (A e B) para a produção de Y.Portanto, a resposta correta é a alternativa A.Continua após a publicidade..70) O óxido de cálcio, conhecido comercialmente como cal virgem, é um dos materiais de construção utilizado há mais tempo. Para sua obtenção, a rocha calcária é moída e aquecida a uma temperatura de cerca de 900°C em diversos tipos de fornos, onde ocorre sua decomposição térmica. O principal constituinte do calcário é o carbonato de cálcio, e a reação de decomposição é representada pela equação:
FAZER COMENTÁRIO- A) aumentar a pressão do sistema.
- B) diminuir a pressão do sistema.
- C) acrescentar CO2 ao sistema, mantendo o volume constante.
- D) acrescentar CaCO3 ao sistema, mantendo a pressão e o volume constantes.
- E) retirar parte do CaCO3 do sistema, mantendo a pressão e o volume constantes.
A alternativa correta é letra B
Como o enunciado afirma que o sistema está em equilíbrio, para aumentar a produção do óxido de cálcio (CaO), devemos deslocar este equilíbrio para a direita. Para que isto ocorra, devemos diminuir a pressão do sistema, alternativa b).A diminuição da pressão do sistema, desloca o equilíbrio químico na direção da formação do único componente gasoso (CO2). O aumento na formação de CO2 leva a um aumento na formação de CaO. - B) I e IV
- B) I e III, apenas.
- B) 25;
- B) Kc = [SO3]2/ [O2].[SO2]2
- B) a reação entre CO2 e H2 apresenta Kc igual a 12,5 a 400ºC.
